
- •Введение.
- •Тема 1. Кинематика поступательного движения материальной точки.
- •Тема 2. Динамика поступательного движения.
- •Тема 3. Кинематика и динамика вращательного движения.
- •Угловую скорость ω движения, угловое ускорение ε через 2с после начала движения.
- •Тангенциальное и нормальное ускорения через 2с после начала движения.
- •Тема 4. Законы сохранения энергии, импульса,
- •Тема 5. Колебательное движение.
- •Тема 6. Упругие волны.
- •Тема 7. Молекулярная физика и термодинамика.
- •Тема 8. Основы статистической физики.
- •Тема 9. Явления переноса в газах.
Тема 7. Молекулярная физика и термодинамика.
Количество
вещества
– физическая
величина,
характеризующая количество однотипных
структурных единиц, содержащихся в
веществе.
1 моль (ν)
вещества содержит
![]() моль-1
(постоянная Авогадро) структурных единиц
моль-1
(постоянная Авогадро) структурных единиц
![]() .
.
Идеальный газ – физическая модель газа, размерами и взаимодействием молекул которого можно пренебречь.
Уравнение
состояния идеального газа
(Менделеева-Клапей-рона)
![]() ,
где R
= 8,31Дж/моль.К
– универсальная газовая постоянная,
или
,
где R
= 8,31Дж/моль.К
– универсальная газовая постоянная,
или
![]() ,
где
,
где
![]() Дж/К
– постоянная Больцмана
Дж/К
– постоянная Больцмана
![]() .
.
Уравнение
состояния реального газа
(Ван-дер-Ваальса)
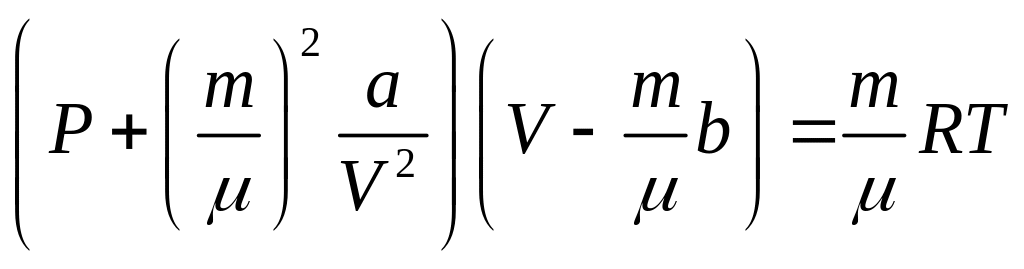 ,
где
,
где
![]() – собственный объём молекул одного
моля, а
– коэффициент зависящий от природы
газа и определяющий взаимодействие
молекул.
– собственный объём молекул одного
моля, а
– коэффициент зависящий от природы
газа и определяющий взаимодействие
молекул.
Основное уравнение молекулярно-кинетической теории
![]() ,
где Е
–
энергия
молекул газа.
,
где Е
–
энергия
молекул газа.
На одну степень свободы молекулы приходится энергия ε = ½ kT.
Число степеней свободы ( i ) – количество независимых координат, описывающих движение молекул.
Для одноатомных молекул i = 3 (поступательные степени свободы), для двухатомных i = 5 (3 поступательных + 2 вращательные), для трехатомных и многоатомных i = 6 ( 3 поступательных + 3 вращательных).
Внутренняя
энергия идеального газа
![]() .
.
Изменение
внутренней энергии связано только с
изменением температуры
![]() .
.
Внутренняя
энергия реального газа
![]() ,
где
,
где
![]() –
теплоемкость
идеального газа при постоянном давлении.
–
теплоемкость
идеального газа при постоянном давлении.
Работа
газа
 .
.
Первое
начало термодинамики
![]() :
теплота, сообщаемая системе, расходуется
на изменение внутренней энергии системы
и на совершение системой работы против
внешних сил.
:
теплота, сообщаемая системе, расходуется
на изменение внутренней энергии системы
и на совершение системой работы против
внешних сил.
Теплоемкость
– величина, численно равная количеству
тепла, которое нужно сообщить телу,
чтобы повысить его температуру на 1К
![]() .
.
Удельная
теплоемкость
– величина, численно равная количеству
тепла, которое нужно сообщить единице
массы тела, чтобы повысить его температуру
на 1К
![]() .
.
Молярная
теплоемкость
– величина, численно равная количеству
тепла, которое нужно сообщить молю
вещества, чтобы повысить его температуру
на 1К
![]() .
.
Адиабатический
процесс
– процесс, протекающий без теплообмена
с внешней средой , т.е.
![]() и
и
![]() .
.
Уравнение
адиабатического процесса
(уравнение Пуассона)
![]() ,
,
![]() ,
где
,
где
![]() – показатель адиабаты.
– показатель адиабаты.
Изопроцесс |
уравнение |
I -ое начало |
работа |
молярная теплоемкость |
Изотермический T=const |
P2V2=P1V1 |
Q = A |
|
∞ |
Изобарический P=const |
|
Q = ΔU + A |
P(V2-V1) |
|
Изохорный V=const |
|
Q = ΔU |
0 |
|
Адиабатический |
|
Q = 0 |
Α = –ΔU =
|
0 |
Второе начало термодинамики. Наиболее часто встречаются формулировки:
– невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя в эквивалентную ей работу.
– невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему.
– энтропия
замкнутой системы при любых происходящих
в ней процессах не может убывать
![]() (здесь
(здесь
![]() –
энтропия системы,
–
термодинамическая вероятность состояния),
в итоге еще одна формулировка:
–
энтропия системы,
–
термодинамическая вероятность состояния),
в итоге еще одна формулировка:
– термодинамическая
вероятность состояния замкнутой системы
при всех происходящих в ней процессах
не может убывать
![]() .
.
Изменение
энтропии
![]() или
или
![]() .
.
Коэффициент
полезного действия теплового
двигателя
![]() , где
А
– работа, совершенная в цикле,
, где
А
– работа, совершенная в цикле,
![]() –
количество
теплоты, полученное от нагревателя,
–
количество
теплоты, полученное от нагревателя,
![]() – количество теплоты отданное охладителю.
– количество теплоты отданное охладителю.
Кпд
цикла Карно
![]() .
.
![]() – температура нагревателя,
– температура нагревателя,
![]() – температура охладителя (холодильника).
– температура охладителя (холодильника).
Теоремы
Карно
1.
Коэффициент полезного действия любой
обратимой тепловой машины, не зависит
от природы рабочего тела и устройства
машины, а является функцией только
температуры нагревателя и холодильника: ![]()
2.
Коэффициент полезного действия любой
тепловой машины, работающей по необратимому
циклу, меньше коэффициента полезного
действия машины с обратимым циклом
Карно, при условии равенства температур
их нагревателей и холодильников:
![]() .
.
Коэффициент
полезного действия или холодильный
коэффициент
холодильной машины можно определить
как отношение отнятой от охлаждаемого
тела теплоты
![]() к
затраченной для этого механической
работе А:
к
затраченной для этого механической
работе А:
![]() .
.
![]() –
количество теплоты переданное тепловому
резервуару.
–
количество теплоты переданное тепловому
резервуару.
Задание по теме.
В сосуде объёмом V1 = 6 л при давлении Р1= 0,4 МПа находится один моль двухатомного газа, который затем совершает замкнутый цикл, состоящий из последовательных процессов (согласно таблице вариантов).
вариант |
1-2 |
2-3 |
3-4 |
4-1 |
1 |
Изобара V2=3V1 |
Изотерма V3=1,5V2 |
Изобара до Т3=Т1 |
изотерма |
2 |
Изобара V2=3V1 |
Изотерма V3=1,5V2 |
Изохора до Т3=Т1 |
изотерма |
3 |
Изобара V2=3V1 |
Адиабата V3=1,5V2 |
Изобара до V3=V1 |
изохора |
4 (пример) |
Изотерма V2=4V1 |
Изохора Р3=3Р2 |
Изотерма до Р4=Р1 |
изобара |
|
1-2 |
2-3 |
3-1 |
---- |
5 |
Изобара Т2=2Т1 |
Изохора Т=Т1 |
Изотерма |
---- |
6 |
Изохора Р2=2Р1 |
Изотерма Р3=Р1 |
Изобара |
---- |
7 |
Адиабата V2=1,5V1 |
Изобара Т=Т1 |
Изотерма |
---- |
1. Найти параметры точек 2, 3 и 4. Изобразить цикл в координатах: Р, V ; V, Т и Р, Т .
2. Найти количество теплоты Q, поглощенное в цикле.
3. Найти количество теплоты Q, выделенное газом в цикле.
4. Найти работу, совершенную газом в цикле.
5. Найти кпд цикла.
6. Найти изменение внутренней энергии ΔU при переходе а) 1-2; б) 2-3; в) 3-4; г) 1-3; д) 2-4; е) 4-1; ж) 3-1 .
7. Найти изменение энтропии ΔS в процессе а) 1-2;
б) 2-3; в) 3-4; г) 1-3; д) 2-4; е) 4-1; ж) 3-1 .
Пример решения варианта 4.
Температура
начального состояния по уравнению
Менделеева-Клапейрона
![]() .
.
Уравнение изотермического процесса 1-2:
![]() ,
откуда
,
откуда
![]() .
.
Уравнение изохорического процесса 2-3:
![]() ,
откуда
,
откуда
![]() .
.
Уравнение изотермического процесса 3-4:
![]() ,
откуда
,
откуда
![]() .
.
точка |
P , 106 Па |
V , 103 м3 |
T , К |
1 |
0,4 |
6 |
290 |
2 |
0,1 |
24 |
290 |
3 |
0,3 |
24 |
870 |
4 |
0,4 |
18 |
870 |
Нанесем эти точки на оси и построим графики процессов.
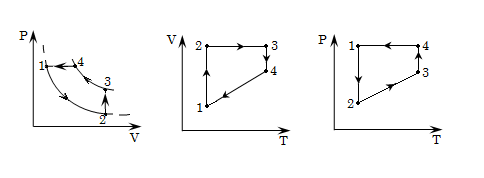
Теплота поглощенная или выделенная в процессах:
1-2 изотермический
![]() ;
;
изохорический
![]() ;
;
3-4 изотермический
![]() ;
;
4-1 изобарический

В процессах 1-2 и 2-3 теплота положительная, следовательно, шло её поглощение от нагревателя. В процессах 3-4 и 4-1 – отрицательная, следовательно, система отдает теплоту охладителю. Тогда отвечая на вопрос 2:
![]() .
.
Отвечая на вопрос 3:
![]() .
.
4.
Так как цикл замкнутый, изменение
внутренней энергии
![]() ,
тогда работа в цикле
,
тогда работа в цикле
![]() .
.
5. Работа
в цикле отрицательная, а это значит, что
такой цикл обратный (на это указывает
и направление процесса в параметрах ).
В этом случае цикл соответствует
холодильной машине, для которой
определяется холодильный коэффициент:
![]() .
(В отличие от кпд теплового двигателя
кпд холодильной машины может быть больше
1).
.
(В отличие от кпд теплового двигателя
кпд холодильной машины может быть больше
1).
6.
Изменение внутренней энергии в
процессах находим по определению:
![]() .
.
7. Изменение энтропии идеального газа

В
соответствии с этой формулой изменение
энтропии в процессе 1-2
![]() .
.
В
процессе 2-3
![]() .
Так
как энтропия является термодинамическим
потенциалом, то для процесса 1-3
.
Так
как энтропия является термодинамическим
потенциалом, то для процесса 1-3
![]() .
.
