
- •Вопрос 1 Сырье для производства синтетического аммиака. Способы получения водорода и азота
- •Двухступенчатая организация конверсии природного газа.
- •Вопрос 2 Паровая конверсия природного газа: реакции и равновесие процесса.
- •Вопрос 3 Паровая конверсия природного газа: катализаторы.
- •Паровая конверсия природного газа: кинетика.
- •Параметры первой ступени конверсии природного газа.
- •Оборудование конверсии природного газа 1 ступени. Многорядная трубчатая печь.
- •Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
- •Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
- •Вопрос 6 Двухступенчатая организация процесса конверсии природного газа.
- •Особенности второй ступени конверсии.
- •Реакции и равновесие процесса
- •Вопрос 7 Паровоздушная конверсия метана: кинетика, катализаторы и параметры процесса.
- •Вопрос 8 Оборудование стадии паровоздушной конверсии природного газа
- •9. 10. Двухступенчатая организация конверсии монооксида углерода. Конверсия монооксида углерода: реакции и равновесие процесса.
- •Методика расчета материального баланса процесса конверсии со.
- •Методика расчета теплового баланса конвертора со .
- •Очистка конвертированного газа от диоксида углерода. Требования, предъявляемые к хемосорбенту и массообменной аппаратуре.
- •Моноэтаноламиновая очистка: реакции, равновесие, кинетика и параметры процесса.
- •15. Оборудование стадии очистки конвертированного газа от диоксида углерода и регенерации раствора
- •Технологическая схема мэа-очистки.
- •Очистка конвертерного газа от со2 по методу «карсол».
- •18.Физико-химические свойства nн3.Требования к качеству nн3.Синтез nн3 :реакция,равновесие процесса
- •Требования к качеству продукционного nн3 по гост 6221 – 90.
- •19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
- •20. Оборудование стадии синтеза nн3.Технологические особенности производств
- •23.Производство нак. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения hno3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
- •25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
- •27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
- •28. Оборудование стадии абсорбции нитрозных газов.
- •30.Методика расчета материального баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
- •34. Синтез карбамида: кинетика и параметры процесса. Диаграмма состояния системы.
- •35. Оборудование стадии синтеза карбамида. Расходные коэффициенты на 1 т карбамида. Технологические особенности производства карбамида.
- •36. Технологические схемы получения карбамида.
- •Вопрсо№39: Методика расчета материального баланса аппарата итн
- •Способы получения элементарной серы. Добыча серы. Требования к качеству серы.
- •Сырье для производства h2so4. Серный колчедан и др. Сернистые соединения металлов, газы цветной металлургии, сульфаты Ca, k, Fe.
- •Газы цветной металлургии
- •Физико-химические основы процесса горения серы. Печи для сжигания жидкой серы. Утилизация теплоты горения серы.
- •Методика расчета материального баланса циклонной печи.
- •Методика расчета теплового баланса циклонной печи.
- •47. Равновесие и кинетика процесса окисления диоксида серы
- •48. Катализаторы для окисления диоксида серы. Контактные аппараты для окисления диоксида серы.
- •49. Методика расчета материального баланса контактного аппарата
- •50. Методика расчета теплового баланса контактного аппарата
- •51.Равновесие и кинетика процесса абсорбции триоксида серы.
- •Аппаратурное оформление стадии абсорбции. Моногидратный абсорбер. Олеумный абсорбер, сушильная башня.
- •53.Методика расчета материального баланса моногидратного абсорбера.
- •55. Технологическая схема печного отделения.
- •56. Технологическая схема контактно-компрессорного отделения.
- •57. Технологическая схема сушильно-абсорбционного отделения.
- •58.Способы производства и применение фосфорной кислоты. Сырье и требования к качеству продукционной фосфорной кислоты. Стадии технологического процесса.
- •Разложение апатитового концентрата смесью серной и фосфорной кислот
- •Фильтрация фосфополугидрата на вакуумных фильтрах, гидроудаление
- •Упаривание (концентрирование) фосфорной кислоты
- •Абсорбция газов
- •59.Химизм процесса взаимодействия фосфатов с кислотами. Кинетика процесса разложения фосфатов.
- •Скорость процесса разложения фосфатов (Кинетика)
- •60.Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
- •61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
- •62.Выделение и улавливание фтора при получении и переработке эфк. Оборудование стадии.
- •63.Методика расчета материального баланса отделения экстракции в производстве дигидратной эфк.
- •64.Методика расчета теплового баланса отделения экстракции в производстве дигидратной эфк.
- •65. Производство сложных удобрений на основе эфк. Свойства фосфатов аммония. Физико-химические особенности производства аммофоса и фосфатов аммония.
- •Физико-химические особенности н а рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС. Взаимодействие эфк с nh3 происходит по реак-ям (1)-(3).
- •66 Вопрос. Основное оборудование стадий нейтрализации, гранулирования и сушки при получении фосфатов аммония: струйный реактор, саи, аг, сб, бгс.
- •68. Производство диаммонийфосфата, особенности технологии. Требования на даф
- •1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
- •8. Дать полную характеристику колонне синтеза, как реактору для получения карбамида. Материал колонны синтеза.
- •9. Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического хтп.
- •12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
- •13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
- •14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
- •15. Интенсификация работы оборудования и пути ее увеличения.
- •17.Охт. Дать полную характеристику экстрактору, как реактру для получения эфк.
Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
Цель: определение состава конвертированного газа на выходе из радиантной зоны трубчатой печи.

Схема материальных потоков радиантной зоны трубчатой печи: 1 – горелка; 2 – элемент трубчатой печи; 3 – трубы с катализатором
В трубах печи протекают реакции:
СH4+H2O↔CO+3H2 , ∆H=206 кДж (1)
СO+ H2O↔CO2+H2, ∆H=-41 кДж (2)
C2H6+2H2O↔2CO+5H2, ∆H=347,5 кДж (3)
C3H8+3H2O↔3CO+7H2, ∆H=497,69 кДж (4)
C4H10+4H2O↔4CO+9H2, ∆H=651,27 кДж (5)
C5H12+5H2O↔5CO+11H2, ∆H=913,37 кДж (6)
Исх. данные:
а) 100м3 технологического природного газа (далее ПГ) (поток 1); б) объем добавляемой азотоводородной смеси (далее АВС) 10 м3 (поток 2); в) состав ПГ , % об.: СН4 = 93,7; С2Н6 = 3,3; С3Н8 = 1,6; N2 = 1,4; г) состав АВС, % об.: N2 = 24,54; Н2 = 74,16; СН4 = 1; Аr = 0,3; д) пар на конверсию в избытке, объемное отношение на входе в трубную печь пар: ПГ=3,7:1; е) содержание СН4 в конвертированном газе 9% об. в пересчете на сухой газ; ж) Гомологи СН4конвертируют полностью; з) объемы СО и СО2 в конвертированном газе определяются константой равновесия реакции (2) при температуре конверторного газа; и) температура газовой смеси на выходе из катализаторных труб = 827 °С.
Расчет:
1) Запишем V и состав газовых потоков на входе в печь (технол. ПГ, АВС, ПГ+АВС, м3)
2) Обозначим: V- общий объем сухого газа на выходе из печи, Vco2 – объем СО2 в газе на выходе, Vco – объем СО на выходе, Vн2 – объем н2 на выходе, Vн2о – объем водяного пара вступившего в реакцию с углеводородами.
3) Введем обозначения неизвестных объемов, м3:
х – объем
прореагировавшего метана по реакции
(1), м3;
у – объем прореагировавшего СО по
реакции (2) к моменту прихода системы в
состояние равновесия, м3;
V
– общий объем сухого газа на выходе;
 - объемы соответствующих компонентов
в газе на выходе, м3.
- объемы соответствующих компонентов
в газе на выходе, м3.
4) Выразим объем сухого газа на выходе;
5) Выразим VСН4 оставшегося в газе;
6) Выразим константу равновесия реакции (2) через парциальные объемы:
 ,
(7)
,
(7)
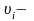 парциальные
объемы компонентов в газе на выходе из
реакционных труб, м3.
парциальные
объемы компонентов в газе на выходе из
реакционных труб, м3.
7) Рассчитаем
константу равновесия реакции при
температуре на выходе из труб по
эмпирической формуле
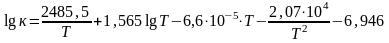 ,
(9)
,
(9)
8) Подставим в (7) соответствующие выражения парциальных объемов и рассчитанное значение константы равновесия. Вместо х подставляем объем метана оставшегося в газе (из пункта 5). После преобразований приходим к квадратному уравнению, решаем его относительно y. Находим х из выражения полученного в 5 пункте.
9) Заполняем таблицу МБ.
Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
Цель: 1) определение прихода теплоты в радиантную зону печи со всеми потоками и расхода теплоты из радиантной зоны со всеми потоками; 2) определение расхода топливного ПГ в топочную зону; 3) определение объема и состава дымовых газов (ДГ) образующихся в межтрубном пространстве печи.

Схема тепловых потоков радиантной зоны трубчатой печи
Уравнение теплового баланса:
Q1 + Q2 + Q3 + Q4 = Q5 + Q6 + Q7 + Q8 (1)
Q1 - физическое тепло парогазовой смеси на входе; Q2 - физическое тепло топливного ПГ; Q3 - физическое тепло воздуха подаваемого в горелке; Q4 – тепло выделяющееся при сгорании топливного природного газа; Q5 – расход тепла на эндотермические реакции; Q6 - физическое тепло конвертированного ПГ, на выходе из катализаторной зоны; Q7 - физическое тепло дымовых газов на выходе из топочной зоны; Q8 – потери тепла в окружающую среду.
Исходные данные:
1) состав газа на входе в радиантную зону печи ПГ+АВС=СН4,С2Н6,С3Н8,С4Н10, С5Н12,N2,Н2,Аr и состав газа на выходе из радиантной зоны СН4,СО,СО2,Н2,N2,Аr, Н2О;
2) Температура газа на входе в катализатор (525 ˚С ) и выходе из него (827 ˚С);
3) Температура дымовых газов на выходе из топочной зоны 10400С;
4) Средняя теплоёмкость компонентов газа (из справочника);
5) Энтальпия и влагосодержание воздуха (из справочника);
6) Энтальпия образования компонентов газа (из справочника);
7) Состав воздуха, подаваемого на сжигание топливного ПГ: О2– 21%, N2– 78%, Ar– 1%;
8) Коэффициент избытка воздуха при сжигании топливного ПГ 1,15;
9) Температура топливного ПГ 85 ˚С;
10) Температура воздуха, подаваемого в горелки 25 ˚С;
11) Относительная влажность воздуха 80%;
12) Потери тепла в окружающую среду 3% от прихода тепла.
Расчет ведётся на 100м3 технологического ПГ.
Расчет:
1) Физическая теплота ПГС на входе в аппарат рассчитывается по формуле (в кДж)
 ,
(2)
,
(2)
где V – объем газовой смеси, м3; c – средняя объемная теплоемкость газовой смеси, (кДж/(м3К)); t – температура газовой смеси,0С. Для нахождения средней объемной теплоемкости газовой смеси нужно рассчитать теплоемкости компонентов парогазовой смеси при заданной температуре по эмпирическим формулам, а затем найти среднюю объемную теплоемкость по правилу аддитивности.
2) Рассчитаем Q2 - физическое тепло топливного ПГ по формуле (2) (аналогично пункту 1).
3) Физическая теплота воздуха Q3, подаваемого в горелки, определяется по формуле:
Q = mсух ∙Нвл , (3)
где mсух – масса сухого воздуха, кг; Нвл - энтальпия влажного воздуха, приходящегося на 1 кг сухого воздуха при заданной Т и относительной влажности, кДж/кг. Рассчитаем теоретический объем кислорода, затрачиваемый на сжигание 1 м3 ПГ по реакциям:
СH4+2O2=CO2+2H2O (4)
С2H6+3,5O2=2CO2+3H2O (5)
С3H8+5O2=3CO2+4H2O (6)
С4H10+6,5O2=4CO2+5H2O (7)
С5H12+8O2=5CO2+6H2O (8)
СО+0,5О2=СО2 (9)
Определим по стехиометрии реакций сколько кислорода используется на реакции (4)-(9). Найдем необходимый объем воздуха. Выполним пересчет на 100 м3 ПГ. Рассчитаем практический объем воздуха с учетом 15% избытка, а затем пересчет объема воздуха на массу. Далее проведем расчет по уравнению (3).
4) Выразим теплоту Q4, выделяющуюся при сгорании топливного ПГ.
Воспользуемся уравнениями реакций горения (4)-(9). Рассчитаем изменения энтальпий по следствию из закона Гесса:
 , (10)
, (10)
 - стандартная
мольная энтальпия образования вещества,
кДж/моль; ni
, nj
- количество
участников реакции, моль.
- стандартная
мольная энтальпия образования вещества,
кДж/моль; ni
, nj
- количество
участников реакции, моль.
5) Выразим общий приход теплоты.
6) Рассчитаем Q5 (тепло расходуемое на эндотермические реакции).
 ,
(11)
,
(11)
Vi – объемы компонентов на выходе из зоны реакции и на входе в нее, м3; ∆Нi – объемные энтальпии образования этих компонентов, кДж/м3.
7) Рассчитаем Q6 физическое тепло конвертированного ПГ на выходе из катализаторной зоны по формуле (2) (аналогично пункту 1).
8) Выразим Q7 физическое тепло дымовых газов на выходе из топочной зоны. Для этого рассчитаем объем ДГ образующихся при сжигании 1 м3 ПГ. Для этого вычислим объёмы компонентов ДГ, т.е. N2, O2, Ar, CO2, Н2О.
VN2=Vсух воздуха∙0,78+VN2прир.газа
VAr=Vсух воздуха∙0,01
VО2=VО2практ – VО2теор
VСО2 и VН2О, образующегося по реакциям:
СН4+2О2=СО2+2Н2О
С2Н6 +3,5О2=2СО2+3Н2О
С3Н8 +5О2=3СО2+4Н2О
К реакционному водяному пару надо прибавить пары воды, поступившие с влажным воздухом. Определим объём ДГ при сгорании 1 м3 топливного ПГ:
V´дг= (VN2+VO2+VAR+VCO2+VH2O) м3
При сгорании х м3 топливного ПГ образуется ДГ:
Vдг= х∙(VN2+VO2+VAR+VCO2+VH2O) м3
9) Выразим потери тепла в окружающую среду Q8.
10) Выразим общий расход тепла.
11) Приравняв приход и расход, найдем неизвестные величины и заполним таблицу ТБ.
