
- •Вопрос 1 Сырье для производства синтетического аммиака. Способы получения водорода и азота
- •Двухступенчатая организация конверсии природного газа.
- •Вопрос 2 Паровая конверсия природного газа: реакции и равновесие процесса.
- •Вопрос 3 Паровая конверсия природного газа: катализаторы.
- •Паровая конверсия природного газа: кинетика.
- •Параметры первой ступени конверсии природного газа.
- •Оборудование конверсии природного газа 1 ступени. Многорядная трубчатая печь.
- •Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
- •Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
- •Вопрос 6 Двухступенчатая организация процесса конверсии природного газа.
- •Особенности второй ступени конверсии.
- •Реакции и равновесие процесса
- •Вопрос 7 Паровоздушная конверсия метана: кинетика, катализаторы и параметры процесса.
- •Вопрос 8 Оборудование стадии паровоздушной конверсии природного газа
- •9. 10. Двухступенчатая организация конверсии монооксида углерода. Конверсия монооксида углерода: реакции и равновесие процесса.
- •Методика расчета материального баланса процесса конверсии со.
- •Методика расчета теплового баланса конвертора со .
- •Очистка конвертированного газа от диоксида углерода. Требования, предъявляемые к хемосорбенту и массообменной аппаратуре.
- •Моноэтаноламиновая очистка: реакции, равновесие, кинетика и параметры процесса.
- •15. Оборудование стадии очистки конвертированного газа от диоксида углерода и регенерации раствора
- •Технологическая схема мэа-очистки.
- •Очистка конвертерного газа от со2 по методу «карсол».
- •18.Физико-химические свойства nн3.Требования к качеству nн3.Синтез nн3 :реакция,равновесие процесса
- •Требования к качеству продукционного nн3 по гост 6221 – 90.
- •19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
- •20. Оборудование стадии синтеза nн3.Технологические особенности производств
- •23.Производство нак. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения hno3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
- •25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
- •27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
- •28. Оборудование стадии абсорбции нитрозных газов.
- •30.Методика расчета материального баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
- •34. Синтез карбамида: кинетика и параметры процесса. Диаграмма состояния системы.
- •35. Оборудование стадии синтеза карбамида. Расходные коэффициенты на 1 т карбамида. Технологические особенности производства карбамида.
- •36. Технологические схемы получения карбамида.
- •Вопрсо№39: Методика расчета материального баланса аппарата итн
- •Способы получения элементарной серы. Добыча серы. Требования к качеству серы.
- •Сырье для производства h2so4. Серный колчедан и др. Сернистые соединения металлов, газы цветной металлургии, сульфаты Ca, k, Fe.
- •Газы цветной металлургии
- •Физико-химические основы процесса горения серы. Печи для сжигания жидкой серы. Утилизация теплоты горения серы.
- •Методика расчета материального баланса циклонной печи.
- •Методика расчета теплового баланса циклонной печи.
- •47. Равновесие и кинетика процесса окисления диоксида серы
- •48. Катализаторы для окисления диоксида серы. Контактные аппараты для окисления диоксида серы.
- •49. Методика расчета материального баланса контактного аппарата
- •50. Методика расчета теплового баланса контактного аппарата
- •51.Равновесие и кинетика процесса абсорбции триоксида серы.
- •Аппаратурное оформление стадии абсорбции. Моногидратный абсорбер. Олеумный абсорбер, сушильная башня.
- •53.Методика расчета материального баланса моногидратного абсорбера.
- •55. Технологическая схема печного отделения.
- •56. Технологическая схема контактно-компрессорного отделения.
- •57. Технологическая схема сушильно-абсорбционного отделения.
- •58.Способы производства и применение фосфорной кислоты. Сырье и требования к качеству продукционной фосфорной кислоты. Стадии технологического процесса.
- •Разложение апатитового концентрата смесью серной и фосфорной кислот
- •Фильтрация фосфополугидрата на вакуумных фильтрах, гидроудаление
- •Упаривание (концентрирование) фосфорной кислоты
- •Абсорбция газов
- •59.Химизм процесса взаимодействия фосфатов с кислотами. Кинетика процесса разложения фосфатов.
- •Скорость процесса разложения фосфатов (Кинетика)
- •60.Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
- •61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
- •62.Выделение и улавливание фтора при получении и переработке эфк. Оборудование стадии.
- •63.Методика расчета материального баланса отделения экстракции в производстве дигидратной эфк.
- •64.Методика расчета теплового баланса отделения экстракции в производстве дигидратной эфк.
- •65. Производство сложных удобрений на основе эфк. Свойства фосфатов аммония. Физико-химические особенности производства аммофоса и фосфатов аммония.
- •Физико-химические особенности н а рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС. Взаимодействие эфк с nh3 происходит по реак-ям (1)-(3).
- •66 Вопрос. Основное оборудование стадий нейтрализации, гранулирования и сушки при получении фосфатов аммония: струйный реактор, саи, аг, сб, бгс.
- •68. Производство диаммонийфосфата, особенности технологии. Требования на даф
- •1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
- •8. Дать полную характеристику колонне синтеза, как реактору для получения карбамида. Материал колонны синтеза.
- •9. Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического хтп.
- •12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
- •13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
- •14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
- •15. Интенсификация работы оборудования и пути ее увеличения.
- •17.Охт. Дать полную характеристику экстрактору, как реактру для получения эфк.
12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
Абс-р АК 1) по хар-ру пр-са: обратимый , равновес-й, 2) по фаз сост-ю: гетерог. 3) по теп эф-тк экзотермический 4) по температуре низкотемпературный(30-400С), 5) по давлению – абсорбция протекает под давлением 0,673 Мпа. 6) по степ перемеш-я – по газу идеального вытеснения, на тарелке полного смешения. 7) по температуному режиму: политермический 8) по времени – непрерывный. Материал – сталь18Х12Т10Н легир хром, никель, титан, футеровка для уменьшения коррозии стальная (высокоуглерод-я). 40 ситч тар улучшают гидродинамический режим в колонне,при проходе газа через отверстие на тарелке образуется пена, что способствует интенсификации абсорбции, для отвода тепла на тарелке расположены змевики.
13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
Разность температура в адиабат. реакторе находится из условий ТБ. Qприх. = Qрасх. Приход адиабат. реактора будет состоять из 1 теплоты: G*c*tн = G*c*tк ±qp*CA0*x*G
Где G – масса в-в, поступающих в реактор, кг; с – средняя теплоемкость в-в, поступающих в реактор, кДж/кг*К; tн – начальная температура в-в на входе в реактор; tк – конечная температура на выходе из реактора; qp – теплота реакции; CA0 – нач. концентрация реагир. в-ва А; х – степень превращения этого вещества. Условно можно принять что с = const.
Перенесем (G*c*tк) влево, тогда:
с* (tн - tк) = ±qp*CA0*x
с*Δt = ±qp*CA0*x
Δt =±(qp*CA0*x)/c
Определим разность температ. в адиабат. реакторе. Можно обозначить (qp*CA0)/c = λ, тогда
Δt =(tн - tк) = ±λ*х
Нарисуем графики зависимостей степени превращения х от t.
Е
 сли
ΔН<0, то х↑, t↑
Если ΔН>0, то х↑, t↓
сли
ΔН<0, то х↑, t↑
Если ΔН>0, то х↑, t↓
Из ур-я адиаб., изм-е Т на любом участке по оси потока пропорц-о степ. превр.: Δt= х, знак ур-я зав. от вида пр-са (экзо, эндо). Для экзот-х р-ий: 6NO + 4NH3 = 5N2 +6 H2O. ΔН= -1811; 6NO2 + 8NH3 = 7N2 +12 H2O. ΔН= -2734: ур-е ад-ты: Δt = +х (1), где - коэф-т адиабат-го изм. Т.
Г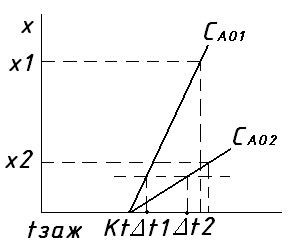 раф.
выр-е ур-я =(qP*Co*β)/c=
(qP*CN2)/c
(2), где qP
- тепло р-ии на 1 m целевого
пр-та, β – поправ-й коэф.,
выр-й отнош. m цел. пр-та
(N2) к m
осн-го исх. в-ва (NO или
NO2), С-теплоемкость:
СО – концентрация основного
исходного в-ва (NO или NO2),
СN2 – концентрация
продукта (N2). Различ.
наклон прямых из-за различ-х нач. конц-й
NOх. Причем САО2
> САО1, чем ниже САО, тем
выше Х. (·) пересеч. с осью абсцисс соотв.
Т зажигания Кт. Катализаторы: АВК – 10,
АП – 2 (алюмопаладиевый).
раф.
выр-е ур-я =(qP*Co*β)/c=
(qP*CN2)/c
(2), где qP
- тепло р-ии на 1 m целевого
пр-та, β – поправ-й коэф.,
выр-й отнош. m цел. пр-та
(N2) к m
осн-го исх. в-ва (NO или
NO2), С-теплоемкость:
СО – концентрация основного
исходного в-ва (NO или NO2),
СN2 – концентрация
продукта (N2). Различ.
наклон прямых из-за различ-х нач. конц-й
NOх. Причем САО2
> САО1, чем ниже САО, тем
выше Х. (·) пересеч. с осью абсцисс соотв.
Т зажигания Кт. Катализаторы: АВК – 10,
АП – 2 (алюмопаладиевый).
14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
КС исп-т для обжига, т-обмена, сушки, адс-и. В печах КС поверхность обжигаемых твердых частиц максимальна и полностью омывается газом, велика турбулентность двухфазной среды и минимальны диффузионные сопротивления, что повышает коэффициенты массо- и теплопередачи. Благодаря перекрестному направлению движения реагентов в этих печах обеспечивается высокая движущая сила и наибольшая полнота процесса, т. е. максимален КПД. Время контакта составляет в печах КС несколько секунд. Температурный режим печи КС изотермический, что облегчает управление процессом, происходящим в реакторе. Тепло реакции горения используется для выработки пара. Недостатком печей КС является высокая запыленность печного газа. Скорость, при которой нарушается неподвижность слоя и он начинает переходить в псевдоожиженное состояние, называют скоростью псевдоожижения и обозначают через Wпс.
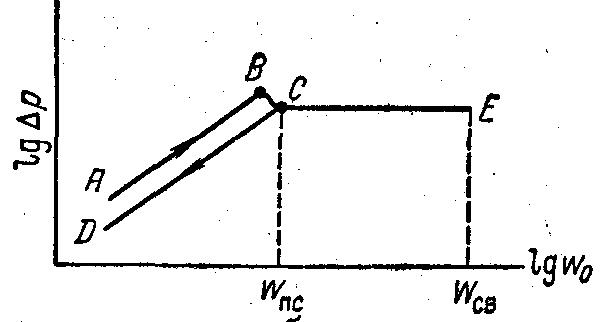
Начало псевдоожижения наступает при равенстве силы гидравлического сопротивления слоя, весу всех его частиц. Но в действительности перепад давлений в слое, соответствующий точке В, т. е. непосредственно перед началом псевдоожижения (точка С), несколько больше величины, необходимой для поддержания слоя во взвешенном состоянии.
Это объясняется действием сил сцепления между частицами слоя, находящегося в покое. Когда скорость потока достигает значения Wпс, частицы преодолевают силы сцепления и перепад давлений становится равным весу частиц, приходящемуся на единицу площади ап-та. Линия СЕ – существование псевдоож-го слоя. Скорость уноса – ск-ть при кот. слой разрывается и нач-ся массовый унос частиц потока Wсв. Отнош-е рабочей ск-ти к ск-ти псевдоожижения – число псевдоожижения: КП = W0/ WПС. Характеризует интенсивность перемешив-я ч-ц. Для каждого конкретного процесса опред-ют оптимал. знач-е КП, интенсивное перемеш-е ч-ц уже достиг-ся при КП = 2. Условие создания КС: наличие скорости между WСВ и WПС.
З-н Архимеда: начало псевдоожижения наступает при равенстве силы гидравлич-го сопрот-я слоя весу всех частиц. Критич-е знач-е Re0 при кот начин-ся псевдоожиж-е: ReПС = Аr/1400 +5.22 (Ar)1/2.
Ar = d3 ∙ ρ 2 ∙ g (ρ ∙ m - ρ)/μ2 ∙ ρ – завис-ть гидр-го сопр-я от факторов:ΔР = f(E, Ф, Re, H, d, ρ, W0) ; Ф – фактор формы, Е – порозность, Н – высота слоя. Скорость псевдоожижения расч-т по формуле:
WПС = Re ∙ n ∙ c ∙ μ /(d ∙ ρ), ρ – плотность среды, кг/м3; d – эквивалентный диаметр, м; μ – динамический коэффициент вязкости, Па∙с.
Зная WПС мож. найти W0; с пом. раб. скорости опред-т диаметр и др габарит раз-ры, и далее гидравл. сопрот. слоя.
