
- •Вопрос 1 Сырье для производства синтетического аммиака. Способы получения водорода и азота
- •Двухступенчатая организация конверсии природного газа.
- •Вопрос 2 Паровая конверсия природного газа: реакции и равновесие процесса.
- •Вопрос 3 Паровая конверсия природного газа: катализаторы.
- •Паровая конверсия природного газа: кинетика.
- •Параметры первой ступени конверсии природного газа.
- •Оборудование конверсии природного газа 1 ступени. Многорядная трубчатая печь.
- •Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
- •Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
- •Вопрос 6 Двухступенчатая организация процесса конверсии природного газа.
- •Особенности второй ступени конверсии.
- •Реакции и равновесие процесса
- •Вопрос 7 Паровоздушная конверсия метана: кинетика, катализаторы и параметры процесса.
- •Вопрос 8 Оборудование стадии паровоздушной конверсии природного газа
- •9. 10. Двухступенчатая организация конверсии монооксида углерода. Конверсия монооксида углерода: реакции и равновесие процесса.
- •Методика расчета материального баланса процесса конверсии со.
- •Методика расчета теплового баланса конвертора со .
- •Очистка конвертированного газа от диоксида углерода. Требования, предъявляемые к хемосорбенту и массообменной аппаратуре.
- •Моноэтаноламиновая очистка: реакции, равновесие, кинетика и параметры процесса.
- •15. Оборудование стадии очистки конвертированного газа от диоксида углерода и регенерации раствора
- •Технологическая схема мэа-очистки.
- •Очистка конвертерного газа от со2 по методу «карсол».
- •18.Физико-химические свойства nн3.Требования к качеству nн3.Синтез nн3 :реакция,равновесие процесса
- •Требования к качеству продукционного nн3 по гост 6221 – 90.
- •19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
- •20. Оборудование стадии синтеза nн3.Технологические особенности производств
- •23.Производство нак. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения hno3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
- •25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
- •27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
- •28. Оборудование стадии абсорбции нитрозных газов.
- •30.Методика расчета материального баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
- •34. Синтез карбамида: кинетика и параметры процесса. Диаграмма состояния системы.
- •35. Оборудование стадии синтеза карбамида. Расходные коэффициенты на 1 т карбамида. Технологические особенности производства карбамида.
- •36. Технологические схемы получения карбамида.
- •Вопрсо№39: Методика расчета материального баланса аппарата итн
- •Способы получения элементарной серы. Добыча серы. Требования к качеству серы.
- •Сырье для производства h2so4. Серный колчедан и др. Сернистые соединения металлов, газы цветной металлургии, сульфаты Ca, k, Fe.
- •Газы цветной металлургии
- •Физико-химические основы процесса горения серы. Печи для сжигания жидкой серы. Утилизация теплоты горения серы.
- •Методика расчета материального баланса циклонной печи.
- •Методика расчета теплового баланса циклонной печи.
- •47. Равновесие и кинетика процесса окисления диоксида серы
- •48. Катализаторы для окисления диоксида серы. Контактные аппараты для окисления диоксида серы.
- •49. Методика расчета материального баланса контактного аппарата
- •50. Методика расчета теплового баланса контактного аппарата
- •51.Равновесие и кинетика процесса абсорбции триоксида серы.
- •Аппаратурное оформление стадии абсорбции. Моногидратный абсорбер. Олеумный абсорбер, сушильная башня.
- •53.Методика расчета материального баланса моногидратного абсорбера.
- •55. Технологическая схема печного отделения.
- •56. Технологическая схема контактно-компрессорного отделения.
- •57. Технологическая схема сушильно-абсорбционного отделения.
- •58.Способы производства и применение фосфорной кислоты. Сырье и требования к качеству продукционной фосфорной кислоты. Стадии технологического процесса.
- •Разложение апатитового концентрата смесью серной и фосфорной кислот
- •Фильтрация фосфополугидрата на вакуумных фильтрах, гидроудаление
- •Упаривание (концентрирование) фосфорной кислоты
- •Абсорбция газов
- •59.Химизм процесса взаимодействия фосфатов с кислотами. Кинетика процесса разложения фосфатов.
- •Скорость процесса разложения фосфатов (Кинетика)
- •60.Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
- •61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
- •62.Выделение и улавливание фтора при получении и переработке эфк. Оборудование стадии.
- •63.Методика расчета материального баланса отделения экстракции в производстве дигидратной эфк.
- •64.Методика расчета теплового баланса отделения экстракции в производстве дигидратной эфк.
- •65. Производство сложных удобрений на основе эфк. Свойства фосфатов аммония. Физико-химические особенности производства аммофоса и фосфатов аммония.
- •Физико-химические особенности н а рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС. Взаимодействие эфк с nh3 происходит по реак-ям (1)-(3).
- •66 Вопрос. Основное оборудование стадий нейтрализации, гранулирования и сушки при получении фосфатов аммония: струйный реактор, саи, аг, сб, бгс.
- •68. Производство диаммонийфосфата, особенности технологии. Требования на даф
- •1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
- •8. Дать полную характеристику колонне синтеза, как реактору для получения карбамида. Материал колонны синтеза.
- •9. Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического хтп.
- •12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
- •13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
- •14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
- •15. Интенсификация работы оборудования и пути ее увеличения.
- •17.Охт. Дать полную характеристику экстрактору, как реактру для получения эфк.
61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
Р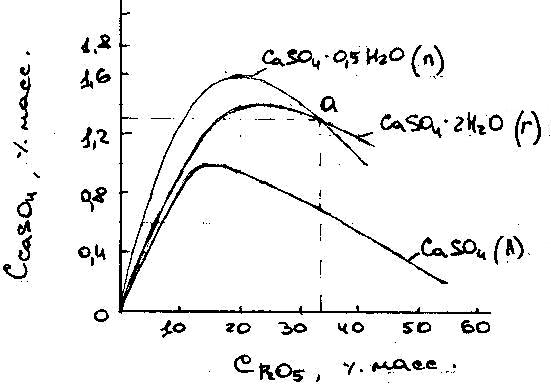 ежимы
экстракции фосфорной кислоты. Основой
для выбора технологических параметров
пр-са сернокислотного разложения
природных фосфатов явл-ся св-ва системы
СаSO4 , H3PO4,
Н2О в к-ой СаSO4
может сущ-ть в 3-х формах: ангидрита
(СаSO4), полугидрата
(СаSO4*0,5 Н2О)и
дигидрата (СаSO4*2
Н2О -гипса ). Температурные и
концентрационные области кристаллизации
этих форм опред-ся соотношениями их
растворимостей в H3PO4.
На рис. 4 представлены изотермы
растворимости СаSO4
в H3PO4
при 80ºС.
ежимы
экстракции фосфорной кислоты. Основой
для выбора технологических параметров
пр-са сернокислотного разложения
природных фосфатов явл-ся св-ва системы
СаSO4 , H3PO4,
Н2О в к-ой СаSO4
может сущ-ть в 3-х формах: ангидрита
(СаSO4), полугидрата
(СаSO4*0,5 Н2О)и
дигидрата (СаSO4*2
Н2О -гипса ). Температурные и
концентрационные области кристаллизации
этих форм опред-ся соотношениями их
растворимостей в H3PO4.
На рис. 4 представлены изотермы
растворимости СаSO4
в H3PO4
при 80ºС.
Минимальной раств-тью при 80ºС обладает ангидрид, к-рый, следовательно, явл-ся равновесной или стабильной фазой. Метастабильный гипс в р-рах, содержащих <33,2% Р2О5 (т.А пересечения изотерм) (метастабильных кристаллогидратов) превращается непосредственно в ангидрид. В более концентрированных р-рах (правее т.А) сначала происходит конверсия гипса в полугидрат, а уже полугидрат дегидротируется до ангидрида. Эти превращения протекают путем постепенного растворения менее стабильной фазы и одновременной кристаллизации из р-ров более стабильной фазы. На рис. 5 приведена политермическая диаграмма характеризующая направление и последовательность фазовых превращений CaSO4 в системе CaSO4 - H3PO4 - H2O
С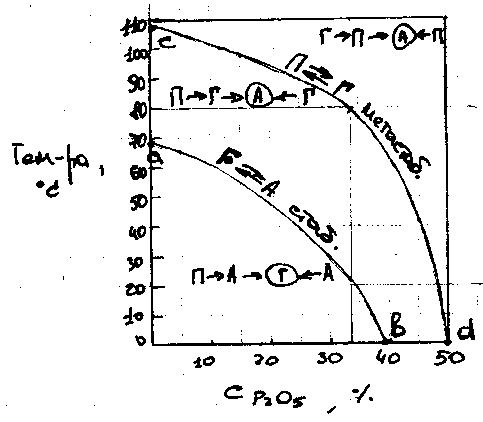 табильно
твердыми фазами в системе является
гипс, ниже кривой аb и
ангидрид (выше аb). В
области, расположенной над кривой cd
полугидрат который обычно является
первой кристаллизирующейся фазой
системы переходит в ангидрид. Однако,
это превращение при 80ºС в растворах
содержащих >33,2% Р2О5 протекает
медленно: сутки и месяцы. В то же время
дегидротация гипса до полугидрата в
тех же условиях завершается значительно
быстрее(часы и минуты). Быстро за 1-5 часов
происходит и дигидротация П→Г при 80ºС
и 10-25% Р2О5. Таким образом
кривая cd является множеством
точек сосуществования метастабильных
фаз Г и П, а кривая ab
множеством точек сосуществования
стабильных фаз Г и А. Однако в реальных
растворах ЭФК фактические границы
областей кристаллизации гипса, полугидрата
и ангидрида и особенно скорости протекания
фазовых превращений существенно
изменяются. Так присутствие заправки
гипса, примесей фосфатов железа,
кремнезема значительно ускоряет переход
П→Г в растворах H3PO4
содержащих 20-30% Р2О5 при 80ºС.
Образовавшийся гипс существует в виде
метастабильной формы (стабильная форма
– ангидрид) в течении нескольких суток
и даже месяцев. Поскольку время пребывания
пульпы в технологической системе
составляет только 5-8 часов, очевидно,
что отфильтрованный в этих условиях
CaSO4, представляет
собой метастабильный дегидрат, т.е.
фосфогипс, а не стабильный ангидрид. На
рисунке 6 изображена диаграмма,
показывающая практическую степень
гидротации CaSO4 в
зависимости от режима экстракции, tºC
и концентрации H3PO4
табильно
твердыми фазами в системе является
гипс, ниже кривой аb и
ангидрид (выше аb). В
области, расположенной над кривой cd
полугидрат который обычно является
первой кристаллизирующейся фазой
системы переходит в ангидрид. Однако,
это превращение при 80ºС в растворах
содержащих >33,2% Р2О5 протекает
медленно: сутки и месяцы. В то же время
дегидротация гипса до полугидрата в
тех же условиях завершается значительно
быстрее(часы и минуты). Быстро за 1-5 часов
происходит и дигидротация П→Г при 80ºС
и 10-25% Р2О5. Таким образом
кривая cd является множеством
точек сосуществования метастабильных
фаз Г и П, а кривая ab
множеством точек сосуществования
стабильных фаз Г и А. Однако в реальных
растворах ЭФК фактические границы
областей кристаллизации гипса, полугидрата
и ангидрида и особенно скорости протекания
фазовых превращений существенно
изменяются. Так присутствие заправки
гипса, примесей фосфатов железа,
кремнезема значительно ускоряет переход
П→Г в растворах H3PO4
содержащих 20-30% Р2О5 при 80ºС.
Образовавшийся гипс существует в виде
метастабильной формы (стабильная форма
– ангидрид) в течении нескольких суток
и даже месяцев. Поскольку время пребывания
пульпы в технологической системе
составляет только 5-8 часов, очевидно,
что отфильтрованный в этих условиях
CaSO4, представляет
собой метастабильный дегидрат, т.е.
фосфогипс, а не стабильный ангидрид. На
рисунке 6 изображена диаграмма,
показывающая практическую степень
гидротации CaSO4 в
зависимости от режима экстракции, tºC
и концентрации H3PO4
В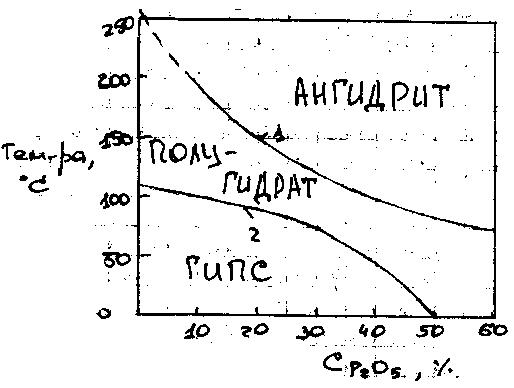 обл. ниже кривой 2 CaSO4
отделяется в виде гипса, выше кривой 1
– в виде ангидрита, а между этими линиями
– в виде полугидрата. В соответствии с
этим различают 3 режима экстракции ФК:
дигидратный, полугидратный, ангидритный.
Наиболее распространен дигидратный
режим, который осуществляется при
65-80С, получая кислоту, содержащую до
32%P2O5.
обл. ниже кривой 2 CaSO4
отделяется в виде гипса, выше кривой 1
– в виде ангидрита, а между этими линиями
– в виде полугидрата. В соответствии с
этим различают 3 режима экстракции ФК:
дигидратный, полугидратный, ангидритный.
Наиболее распространен дигидратный
режим, который осуществляется при
65-80С, получая кислоту, содержащую до
32%P2O5.
Полугидратный режим – 90-100С позволяет получить кислоту до 52% P2O5.
Ангидритный режим пока не реализован из-за опасений усиленой коррозии аппаратуры при повышенных т/рах и плохой фильтруемости ФК и промывных р-ров через слой мелких кристаллов безводного CaSO4.
Оборудование для экстракции фосфорной кислоты.
Аппарат в к-ом осуществляется кислотное разложение фосфатов, называется экстрактором. Это железобетонный футерованный прямоугольный или цилиндрический аппарат большого объёма с плоским дном.
П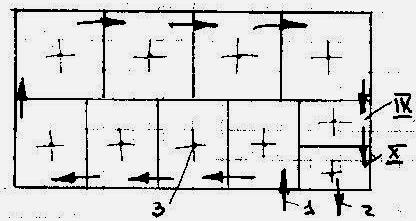 рямоугольный
экстрактор, (V=730-1625 м³)
обычно разделён на 10 квадратных секций:
8-основных и 2- вспомогательных (см.схему,
вид сверху).
рямоугольный
экстрактор, (V=730-1625 м³)
обычно разделён на 10 квадратных секций:
8-основных и 2- вспомогательных (см.схему,
вид сверху).
1-подача фосфатов и др. потоков в 1-ю секцию; 2- отвод пульпы; 3 – двухлопастные мешалки.
В перегородках, разделяющих секции расположены чередующиеся нижние и верхние перегородки так, что пульпа совершает зигзагообразный путь. Фосф.сырьё, серная к-та, р-р разбавления и циркулирующий попадают в 1 секцию. Из 2-х последних секций (9 и 10) отводят полученную пульпу ч/з вакуум-испаритель на рециркуляцию и фильтрацию. Каждая секция снабжена двухлопастной мешалкрй, вращающейся со скоростью 66-72 об/мин.
Цилиндрический экстрактор (V=900 м³) состоит из 2-х реакторов объёмом по 450 м³, соединённых вверху перетоком. Такой реактор перегородок не имеет (вид сверху).
1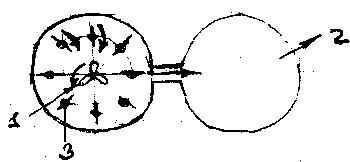 -подача
фосфатов и др. потоков; 2- отвод пульпы;
3 – турбинные мешалки; 4-пропейлерная
мешалка.
-подача
фосфатов и др. потоков; 2- отвод пульпы;
3 – турбинные мешалки; 4-пропейлерная
мешалка.
В центре экстрактора помещают пропеллерную мешалку, а по периферии 8 турбинных мешалок. Турбинные мешалки имеют направление вращения обратное пропеллерной. В цилиндрическом экстракторе обеспечивается большая стабильность процесса по температуре и пересыщению, чем в прямоугольном экстракторе, поэтому получается более однородный осадок СаSO4.
