- •Вопрос 1 Сырье для производства синтетического аммиака. Способы получения водорода и азота
- •Двухступенчатая организация конверсии природного газа.
- •Вопрос 2 Паровая конверсия природного газа: реакции и равновесие процесса.
- •Вопрос 3 Паровая конверсия природного газа: катализаторы.
- •Паровая конверсия природного газа: кинетика.
- •Параметры первой ступени конверсии природного газа.
- •Оборудование конверсии природного газа 1 ступени. Многорядная трубчатая печь.
- •Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
- •Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
- •Вопрос 6 Двухступенчатая организация процесса конверсии природного газа.
- •Особенности второй ступени конверсии.
- •Реакции и равновесие процесса
- •Вопрос 7 Паровоздушная конверсия метана: кинетика, катализаторы и параметры процесса.
- •Вопрос 8 Оборудование стадии паровоздушной конверсии природного газа
- •9. 10. Двухступенчатая организация конверсии монооксида углерода. Конверсия монооксида углерода: реакции и равновесие процесса.
- •Методика расчета материального баланса процесса конверсии со.
- •Методика расчета теплового баланса конвертора со .
- •Очистка конвертированного газа от диоксида углерода. Требования, предъявляемые к хемосорбенту и массообменной аппаратуре.
- •Моноэтаноламиновая очистка: реакции, равновесие, кинетика и параметры процесса.
- •15. Оборудование стадии очистки конвертированного газа от диоксида углерода и регенерации раствора
- •Технологическая схема мэа-очистки.
- •Очистка конвертерного газа от со2 по методу «карсол».
- •18.Физико-химические свойства nн3.Требования к качеству nн3.Синтез nн3 :реакция,равновесие процесса
- •Требования к качеству продукционного nн3 по гост 6221 – 90.
- •19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
- •20. Оборудование стадии синтеза nн3.Технологические особенности производств
- •23.Производство нак. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения hno3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
- •25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
- •27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
- •28. Оборудование стадии абсорбции нитрозных газов.
- •30.Методика расчета материального баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
- •34. Синтез карбамида: кинетика и параметры процесса. Диаграмма состояния системы.
- •35. Оборудование стадии синтеза карбамида. Расходные коэффициенты на 1 т карбамида. Технологические особенности производства карбамида.
- •36. Технологические схемы получения карбамида.
- •Вопрсо№39: Методика расчета материального баланса аппарата итн
- •Способы получения элементарной серы. Добыча серы. Требования к качеству серы.
- •Сырье для производства h2so4. Серный колчедан и др. Сернистые соединения металлов, газы цветной металлургии, сульфаты Ca, k, Fe.
- •Газы цветной металлургии
- •Физико-химические основы процесса горения серы. Печи для сжигания жидкой серы. Утилизация теплоты горения серы.
- •Методика расчета материального баланса циклонной печи.
- •Методика расчета теплового баланса циклонной печи.
- •47. Равновесие и кинетика процесса окисления диоксида серы
- •48. Катализаторы для окисления диоксида серы. Контактные аппараты для окисления диоксида серы.
- •49. Методика расчета материального баланса контактного аппарата
- •50. Методика расчета теплового баланса контактного аппарата
- •51.Равновесие и кинетика процесса абсорбции триоксида серы.
- •Аппаратурное оформление стадии абсорбции. Моногидратный абсорбер. Олеумный абсорбер, сушильная башня.
- •53.Методика расчета материального баланса моногидратного абсорбера.
- •55. Технологическая схема печного отделения.
- •56. Технологическая схема контактно-компрессорного отделения.
- •57. Технологическая схема сушильно-абсорбционного отделения.
- •58.Способы производства и применение фосфорной кислоты. Сырье и требования к качеству продукционной фосфорной кислоты. Стадии технологического процесса.
- •Разложение апатитового концентрата смесью серной и фосфорной кислот
- •Фильтрация фосфополугидрата на вакуумных фильтрах, гидроудаление
- •Упаривание (концентрирование) фосфорной кислоты
- •Абсорбция газов
- •59.Химизм процесса взаимодействия фосфатов с кислотами. Кинетика процесса разложения фосфатов.
- •Скорость процесса разложения фосфатов (Кинетика)
- •60.Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
- •61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
- •62.Выделение и улавливание фтора при получении и переработке эфк. Оборудование стадии.
- •63.Методика расчета материального баланса отделения экстракции в производстве дигидратной эфк.
- •64.Методика расчета теплового баланса отделения экстракции в производстве дигидратной эфк.
- •65. Производство сложных удобрений на основе эфк. Свойства фосфатов аммония. Физико-химические особенности производства аммофоса и фосфатов аммония.
- •Физико-химические особенности н а рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС. Взаимодействие эфк с nh3 происходит по реак-ям (1)-(3).
- •66 Вопрос. Основное оборудование стадий нейтрализации, гранулирования и сушки при получении фосфатов аммония: струйный реактор, саи, аг, сб, бгс.
- •68. Производство диаммонийфосфата, особенности технологии. Требования на даф
- •1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
- •8. Дать полную характеристику колонне синтеза, как реактору для получения карбамида. Материал колонны синтеза.
- •9. Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического хтп.
- •12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
- •13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
- •14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
- •15. Интенсификация работы оборудования и пути ее увеличения.
- •17.Охт. Дать полную характеристику экстрактору, как реактру для получения эфк.
50. Методика расчета теплового баланса контактного аппарата
Расчет производят для каждого слоя катализатора.
На входе в КА: тепло, вносимое с газом (Q1); тепло реакции окисления (Q2).
На выходе: тепло, выходящее с газом (Q3), потери тепла в окружающую среду (Q4=0,05Q2).
Уравнение теплового баланса имеет вид:
![]()
Цель расчета: определить температуру газа на выходе из слоя.
Приход тепла
Расчет Q1
![]()
Расчет Q2
![]()
![]() удельная
теплота окисления при средней температуре
в слое (в справочнике)
удельная
теплота окисления при средней температуре
в слое (в справочнике)
![]() - количество диоксида серы, окислившееся
в триоксид серы.
- количество диоксида серы, окислившееся
в триоксид серы.
Рассчитываем суммарный приход тепла
Расход тепла
Расчет Q4
Q4=0,05Q2
Расчет Q3
![]()
Задаем значение tк и рассчитываем значение средней теплоемкости.
Получаем выражение для нахождения Q3 с неизвестной t.
Рассчитываем суммарный расход тепла
Исходя из условия теплового баланса, приравняв приходную и расходную статьи, находим значение t. Расчет повторяют до тех пор, пока заданное и расчетное t будут различаться на 0,5°С.
Аналогичный расчет повторить для всех слоев катализатора
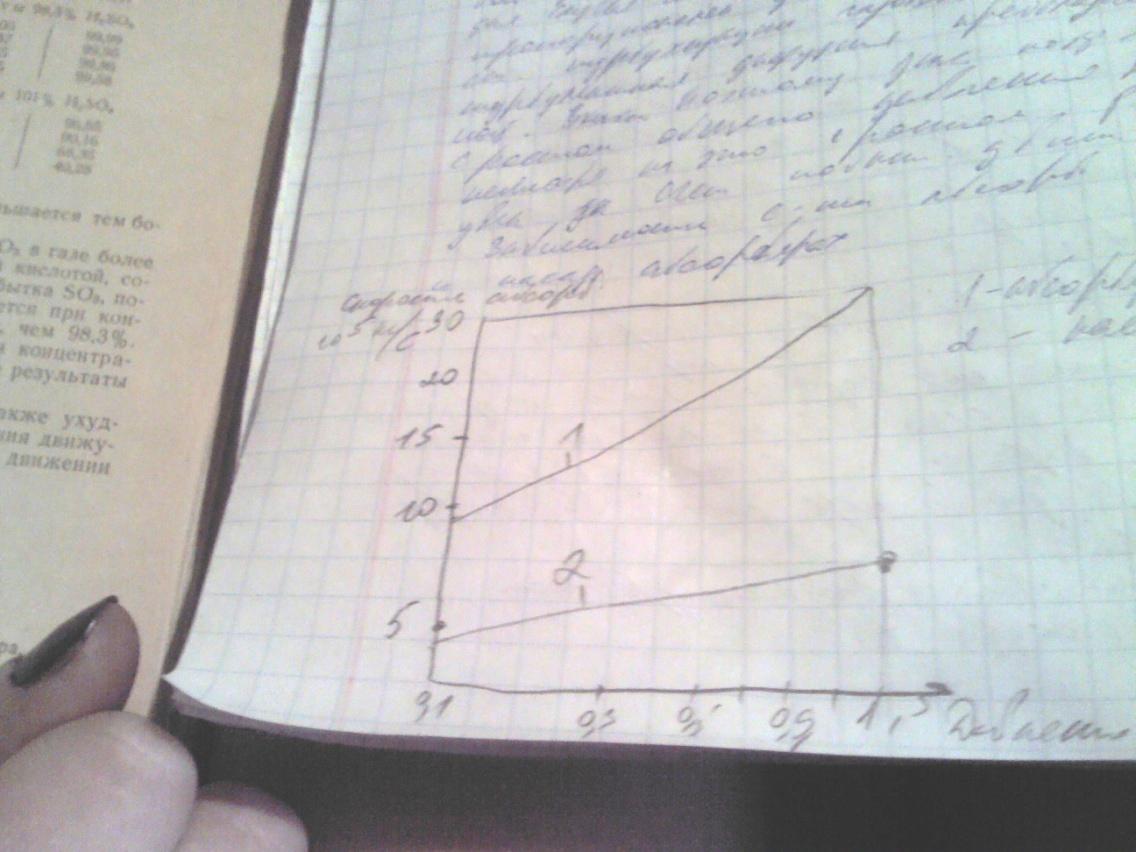
51.Равновесие и кинетика процесса абсорбции триоксида серы.
Последней технологической стадией производства серной к-ты(СК) контактным методом является извлечение SO3 из газовой смеси и превращение ее в СК. Абсорбция SO3 происходит по реакции:
n SO3+H2SO4=H2SO4*SO3+(n-1)SO3, H2SO4*SO3+H2O=2 H2SO4, SO3+mH2O=H2SO4 + (m-1) H2O
В зависимости от количественного соотношения Н2О и SO3 получают H2SO4 различной концентрации при n меньше 1 образуется олеум, при n больше 1 водный раствор H2SO4, n=1 100% H2SO4 или моногидрат.
Газообразный SO3 наиболее полно абсорбируется СК с массовой долей 98,3 %. При мен или большей конц H2SO4 ее способность поглощать SO3 ухудшается, кол-во абсорбирующейся SO3 опред по ф-ле: G=K*F*Δp
К коэф абсорбции, кг/(м2*ч*Па), F – поверхность насадки, м2, Δp – движ сила абсорбции, Па
Движ сила находится по ф-ле:
Δp=(Р1’ – P2’’) – (P2’-P1’’)/(2,3 lg((Р1’ – P2’’)/ (P2’-P1’’))), Р1’ и Р2’ парциальные давления абсорб газа в нач и конц пр-са, Па, P1’’ и P2’’ равновесное давление абсорбирующего газа над жид при вх и вых жид, Па\
К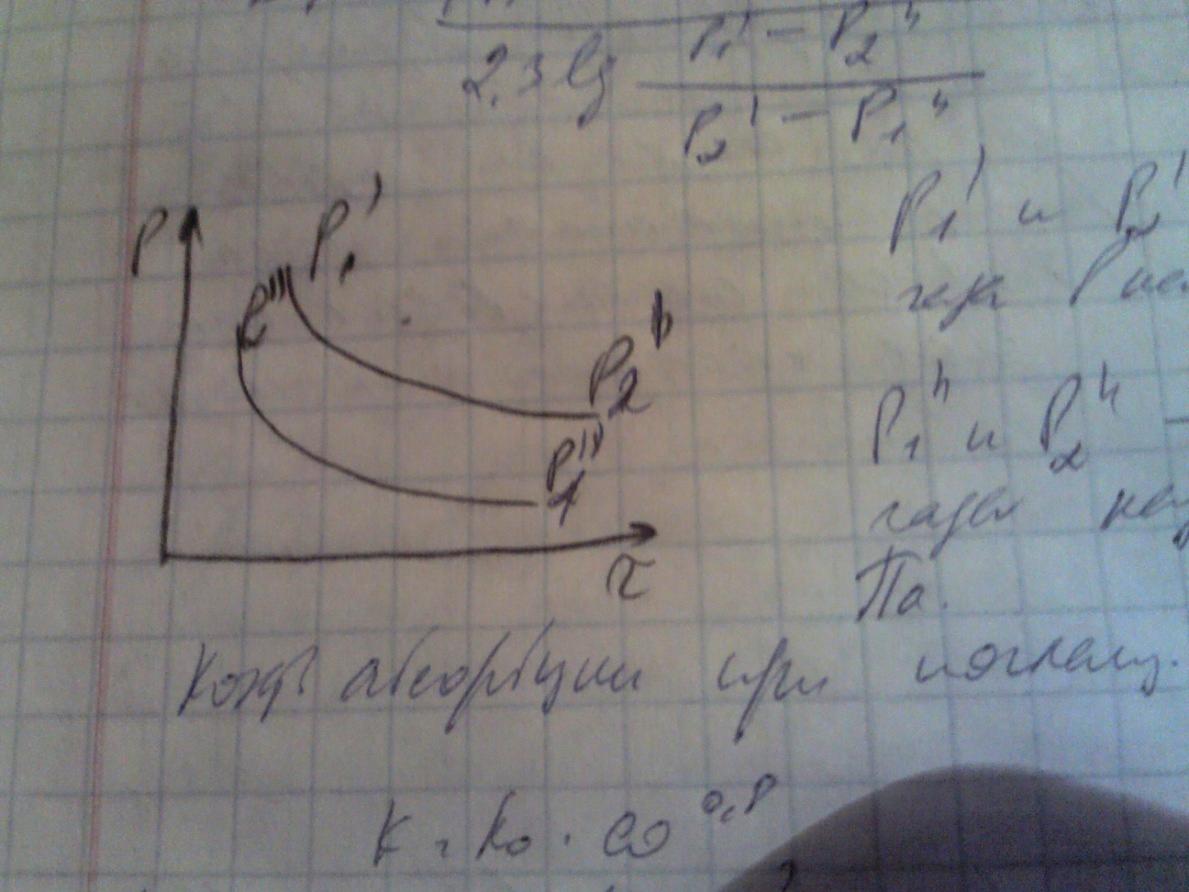 оэф
абсорбции при поглащении SO3
H2SO4,
м.б. определено по ф-ле: К=К0*ω0,8,
К0-
коэф зависящий от конц и температуры
к-ты,, ω фиктивная скорость газа в
абсорбере, без учета заполнения его
насадкой, м/с
оэф
абсорбции при поглащении SO3
H2SO4,
м.б. определено по ф-ле: К=К0*ω0,8,
К0-
коэф зависящий от конц и температуры
к-ты,, ω фиктивная скорость газа в
абсорбере, без учета заполнения его
насадкой, м/с
После абсорбции газовая смесь вместе с поглощенным SO3 выводится в атмосферу. Для умен потерь SO3 с отходящими газами его поглощение должно быть наиб полным , полнота абсорбции зависит также от конц применяемой для абсорбции к-ты. Над СК с конц менее 98,3 % равновесное давление SO3 близко к нулю, а равновесное давление паров воды значительное, поэтому с поверхности СК происходит испаренте молекул воды, основ кол-во молекул SO3 движущихся к поверхности СК абсорбируется ею, но часть молекул встречается с молек воды, испар с поверхности СК и дифундирующими в основной поток газа, сталкиваясь эти молекулы соед с образованием паров СК, к-рые затем конденсируются в объеме с образованием мельчайших капель или тумана СК. SO3газ+Н2Опар= H2SO4пар+ H2SO4туман
Ч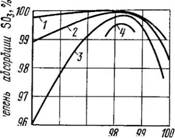 ем
ниже конц СК и выше ее температура, тем
больше выдел из нее паров воды, больше
образуется тумана и больше теряется
SO3
над к-той конц более 98,3% равновесное
давление SO3больше
0, поэтому SO3
абсорбируется СК неполностью, в этом
случае отходящие газы также уносят в
атмосферу часть SO3,
т.е при конц орашающей к-ты менее и более
98,3% от абсорбции SO3
снижается ,она тем ниже чем выше
температура. При конц к-ты 98,3 % равновесные
давления паров воды и SO3
малы и близка к нулю но равновесные
давления паров СК значительны поэтому
происходит испарение паров СК с ее
поверхности, однако при темпер нтже 80
при к-рых на практике ведется пр-сс
абсорбции. Равновесное давление паров
СК оч мало поэтому в производственных
усл. к-ты с конц 98,3 % обладает наиб высокой
абсорбционной способностью по отношению
к SO3.
Повыш температуры сниж ст абсорбции,
т.к повыш давления паров воды над
разбавленной к-той и давлением SO3
над конц к-той, что приводит к образованию
тумана и абсорбер начинает газить.
ем
ниже конц СК и выше ее температура, тем
больше выдел из нее паров воды, больше
образуется тумана и больше теряется
SO3
над к-той конц более 98,3% равновесное
давление SO3больше
0, поэтому SO3
абсорбируется СК неполностью, в этом
случае отходящие газы также уносят в
атмосферу часть SO3,
т.е при конц орашающей к-ты менее и более
98,3% от абсорбции SO3
снижается ,она тем ниже чем выше
температура. При конц к-ты 98,3 % равновесные
давления паров воды и SO3
малы и близка к нулю но равновесные
давления паров СК значительны поэтому
происходит испарение паров СК с ее
поверхности, однако при темпер нтже 80
при к-рых на практике ведется пр-сс
абсорбции. Равновесное давление паров
СК оч мало поэтому в производственных
усл. к-ты с конц 98,3 % обладает наиб высокой
абсорбционной способностью по отношению
к SO3.
Повыш температуры сниж ст абсорбции,
т.к повыш давления паров воды над
разбавленной к-той и давлением SO3
над конц к-той, что приводит к образованию
тумана и абсорбер начинает газить.
Из графика видно, что наилучш абсорбционной способностью обладает обл 98,3% Ск, а при 60С. Для с-мы SO3-Н2SO4 принято считать, скорость массо пперадачи в газовой фазе,коэф масопередачи опред коэф диффузии для случая молекулярной дифузии, он обратно пропорционален давлению. В реал аппаратах ст турбулизации газовой фазы оч ведика и турбулентная диффузия преобладает над молекулярной. Поэтому значение коэф массопередачи с ростом общего давления падает не линейно не смотря на это с ростом р скорость абсорб увел за счет повыш движ силы.
Зависимость степени абсорбции от давления в тарельчатых и насадочных абсорберах.