
- •Вопрос 1 Сырье для производства синтетического аммиака. Способы получения водорода и азота
- •Двухступенчатая организация конверсии природного газа.
- •Вопрос 2 Паровая конверсия природного газа: реакции и равновесие процесса.
- •Вопрос 3 Паровая конверсия природного газа: катализаторы.
- •Паровая конверсия природного газа: кинетика.
- •Параметры первой ступени конверсии природного газа.
- •Оборудование конверсии природного газа 1 ступени. Многорядная трубчатая печь.
- •Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
- •Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
- •Вопрос 6 Двухступенчатая организация процесса конверсии природного газа.
- •Особенности второй ступени конверсии.
- •Реакции и равновесие процесса
- •Вопрос 7 Паровоздушная конверсия метана: кинетика, катализаторы и параметры процесса.
- •Вопрос 8 Оборудование стадии паровоздушной конверсии природного газа
- •9. 10. Двухступенчатая организация конверсии монооксида углерода. Конверсия монооксида углерода: реакции и равновесие процесса.
- •Методика расчета материального баланса процесса конверсии со.
- •Методика расчета теплового баланса конвертора со .
- •Очистка конвертированного газа от диоксида углерода. Требования, предъявляемые к хемосорбенту и массообменной аппаратуре.
- •Моноэтаноламиновая очистка: реакции, равновесие, кинетика и параметры процесса.
- •15. Оборудование стадии очистки конвертированного газа от диоксида углерода и регенерации раствора
- •Технологическая схема мэа-очистки.
- •Очистка конвертерного газа от со2 по методу «карсол».
- •18.Физико-химические свойства nн3.Требования к качеству nн3.Синтез nн3 :реакция,равновесие процесса
- •Требования к качеству продукционного nн3 по гост 6221 – 90.
- •19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
- •20. Оборудование стадии синтеза nн3.Технологические особенности производств
- •23.Производство нак. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения hno3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
- •25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
- •27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
- •28. Оборудование стадии абсорбции нитрозных газов.
- •30.Методика расчета материального баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
- •34. Синтез карбамида: кинетика и параметры процесса. Диаграмма состояния системы.
- •35. Оборудование стадии синтеза карбамида. Расходные коэффициенты на 1 т карбамида. Технологические особенности производства карбамида.
- •36. Технологические схемы получения карбамида.
- •Вопрсо№39: Методика расчета материального баланса аппарата итн
- •Способы получения элементарной серы. Добыча серы. Требования к качеству серы.
- •Сырье для производства h2so4. Серный колчедан и др. Сернистые соединения металлов, газы цветной металлургии, сульфаты Ca, k, Fe.
- •Газы цветной металлургии
- •Физико-химические основы процесса горения серы. Печи для сжигания жидкой серы. Утилизация теплоты горения серы.
- •Методика расчета материального баланса циклонной печи.
- •Методика расчета теплового баланса циклонной печи.
- •47. Равновесие и кинетика процесса окисления диоксида серы
- •48. Катализаторы для окисления диоксида серы. Контактные аппараты для окисления диоксида серы.
- •49. Методика расчета материального баланса контактного аппарата
- •50. Методика расчета теплового баланса контактного аппарата
- •51.Равновесие и кинетика процесса абсорбции триоксида серы.
- •Аппаратурное оформление стадии абсорбции. Моногидратный абсорбер. Олеумный абсорбер, сушильная башня.
- •53.Методика расчета материального баланса моногидратного абсорбера.
- •55. Технологическая схема печного отделения.
- •56. Технологическая схема контактно-компрессорного отделения.
- •57. Технологическая схема сушильно-абсорбционного отделения.
- •58.Способы производства и применение фосфорной кислоты. Сырье и требования к качеству продукционной фосфорной кислоты. Стадии технологического процесса.
- •Разложение апатитового концентрата смесью серной и фосфорной кислот
- •Фильтрация фосфополугидрата на вакуумных фильтрах, гидроудаление
- •Упаривание (концентрирование) фосфорной кислоты
- •Абсорбция газов
- •59.Химизм процесса взаимодействия фосфатов с кислотами. Кинетика процесса разложения фосфатов.
- •Скорость процесса разложения фосфатов (Кинетика)
- •60.Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
- •61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
- •62.Выделение и улавливание фтора при получении и переработке эфк. Оборудование стадии.
- •63.Методика расчета материального баланса отделения экстракции в производстве дигидратной эфк.
- •64.Методика расчета теплового баланса отделения экстракции в производстве дигидратной эфк.
- •65. Производство сложных удобрений на основе эфк. Свойства фосфатов аммония. Физико-химические особенности производства аммофоса и фосфатов аммония.
- •Физико-химические особенности н а рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС. Взаимодействие эфк с nh3 происходит по реак-ям (1)-(3).
- •66 Вопрос. Основное оборудование стадий нейтрализации, гранулирования и сушки при получении фосфатов аммония: струйный реактор, саи, аг, сб, бгс.
- •68. Производство диаммонийфосфата, особенности технологии. Требования на даф
- •1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
- •8. Дать полную характеристику колонне синтеза, как реактору для получения карбамида. Материал колонны синтеза.
- •9. Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического хтп.
- •12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
- •13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
- •14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
- •15. Интенсификация работы оборудования и пути ее увеличения.
- •17.Охт. Дать полную характеристику экстрактору, как реактру для получения эфк.
33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
Сырье: аммиак жидкий и диоксид углерода. Кооперирование пр-ва карбамида с пр-вом аммиака имеет экономическое и природоохранное значение, при получении аммиака из ПГ образ-ся в качестве отхода значительный объем СО2. С целью утилизации СО2 и ↓ затрат на сырье, пр-во карбамида размещают на той же строительной площадке, что и пр-во аммиака.
Требования к качеству по гост 2081-2010: Изготавливают 2 марок: А- для промышленности, Б- для с/х. Может использоваться для животноводства в качестве кормовой добавки.
Показатель |
Марка А |
Марка Б |
|||
Высший сорт |
Первый сорт |
Высший сорт |
Первый сорт |
||
М.д.азота в пересчете на сухое вещество, %, н.м. |
46,3 |
46,2 |
46,2 |
46,2 |
|
М.д. биурета, %, н. б. |
0,6 |
1,4 |
1,4 |
1,4 |
|
М.д. аммиака, %, н.б. - кристаллического - приллированного |
0,01 0,02 |
0,01 0,03 |
- - |
- - |
|
М.д. воды, %, не более: - метод высушивания - метод Фишера |
0,3 0,6 |
0,3 0,6 |
0,3 0,5 |
0,3 0,5 |
|
Гранулометрический состав, %, м.д. гранул размером, мм от 1 до 4 , не менее от 2 до 4, не менее менее 1 мм, не более |
- - -
|
- - -
|
94 70 3
|
94 50 5
|
|
прочность гранул, кгс/гранулу, н.м. |
- |
- |
0,7 |
0,5 |
|
Рассыпчатость, % |
- |
- |
100 |
100 |
|
Карбамид CO(NH2)2- содержит 46,67 % азота. Применяется и в промышленности: карбамидные смолы для пластмасс, аминопластов, синтетических клеев. Применяется для фармацевтической пром-ти, исп-ся для очистки нефтепродуктов.
Физико-хим-е св-ва: Внешний вид: белые гранулы. Мr, г/моль: 60,056. Температура кристаллизации при 0,1 МПа,0С: 132,7. Плотность при 250С, кг/м3: 1330
Карбамид не взрывоопасен, медленно вымывается из почвы, менее гигроскопичен и не сильно слеживается. Карбамид хорошо растворяется в воде. С ↑ t eго растворимость ↑.
Гигроскопической точкой вещества называется такая относительная влажность в-ва, при кот-й в-во находится в равновесии с воздухом, т.е. не увлажняется и не подсыхает. Гигроскопическая точка карбамида с ↑ t снижается.
Современное промышленное произв-во карбамида основано на р-ции Базарова (открыта в 1868г): 2NH3г + CO2г↔ CO(NH2)2ж + H2Oж; ΔН = - 110,1 кДж (1)
Синтез карбамида протекает в жидкой фазе в две стадии. Сначала обр-ся карбамат аммония по р-ции: 2NH3 (г) + CO2(г) ↔ NH2СООNH4(ж); ΔН = –125,6кДж (2)
Затем происходит дегидратация карбамата:
NH2СООNH4(ж) ↔ CO(NH2)2(ж) + H2O (ж); ΔН = 15,5кДж (3)
Сум-я р-ция – (1). Св-ва промежуточного соединения влияют на режим синтеза карбамида. При обычной t карбамат аммония – белое кристаллич. в-во с t пл-я 1520С. Карбамат аммония не стоек, при 570С давление паров NН3 и СО2 над ним равно атм-му, а при 152 0С давление достигает 83,5 ат. (ветвь 1 на диаграмме состояния) → повышение t смещает равновесие р-ции (2) влево, что нежелательно. Реакция (2) при невысокой t и атм-м давлении протекает медленно. С ↑ t и давления, скорость р-ции (2) ↑. Скорость примерно пропорциональна квадрату давления → при 1520С и давлению 100 ат, реакция (2) протекает практически мгновенно. Повышение давления смещает равновесие этой реакции в сторону образования карбамата. Вторая стадия процесса – разложение карбамата аммония, протекает с поглощением тепла, поэтому ↑ t смещает равновесие (3) в право, повышая степень конверсии карбамата в карбамид. Дополнительным фактором, позволяющим смещать равновесие (3) вправо, является участие в процессе аммиака. Аммиак берется в избытке по отношению к стехиометрии р-ции (1), с тем, чтобы связывать воду, образующуюся по (3) в гидроксид аммония. Влияние t и избытка аммиака на равновесную степень конверсии карбамата аммония в карбамид показана на рисунке 1 (4 – избыток аммиака сверх стехиометрич. 50% ; 3 – 100%; 2 - 200%; 1 - 300%).
 Рис.
1
Рис.
1
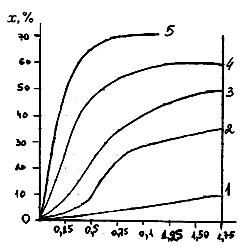 Рис. 2
Рис. 2
Дегидратация карбамата аммония протекает с низкой скоростью, ↑ t позволяет ↑ скорость этой р-ции, влияние продолжит-ти нагревания и t на степень конверсии карбамата аммония (рис. 2): 1 – при 1450 С; 2 –1550 С; 3 –1650 С; 4 – 1750 С; 5 – 1900 С.
Увеличение давления приводит к ↑ степени конверсии карбамата аммония по (3) т.к. повышенное давление препятствует диссоциации карбамата аммония по р-ции (2).
