
- •Вопрос 1 Сырье для производства синтетического аммиака. Способы получения водорода и азота
- •Двухступенчатая организация конверсии природного газа.
- •Вопрос 2 Паровая конверсия природного газа: реакции и равновесие процесса.
- •Вопрос 3 Паровая конверсия природного газа: катализаторы.
- •Паровая конверсия природного газа: кинетика.
- •Параметры первой ступени конверсии природного газа.
- •Оборудование конверсии природного газа 1 ступени. Многорядная трубчатая печь.
- •Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
- •Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
- •Вопрос 6 Двухступенчатая организация процесса конверсии природного газа.
- •Особенности второй ступени конверсии.
- •Реакции и равновесие процесса
- •Вопрос 7 Паровоздушная конверсия метана: кинетика, катализаторы и параметры процесса.
- •Вопрос 8 Оборудование стадии паровоздушной конверсии природного газа
- •9. 10. Двухступенчатая организация конверсии монооксида углерода. Конверсия монооксида углерода: реакции и равновесие процесса.
- •Методика расчета материального баланса процесса конверсии со.
- •Методика расчета теплового баланса конвертора со .
- •Очистка конвертированного газа от диоксида углерода. Требования, предъявляемые к хемосорбенту и массообменной аппаратуре.
- •Моноэтаноламиновая очистка: реакции, равновесие, кинетика и параметры процесса.
- •15. Оборудование стадии очистки конвертированного газа от диоксида углерода и регенерации раствора
- •Технологическая схема мэа-очистки.
- •Очистка конвертерного газа от со2 по методу «карсол».
- •18.Физико-химические свойства nн3.Требования к качеству nн3.Синтез nн3 :реакция,равновесие процесса
- •Требования к качеству продукционного nн3 по гост 6221 – 90.
- •19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
- •20. Оборудование стадии синтеза nн3.Технологические особенности производств
- •23.Производство нак. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения hno3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
- •25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
- •27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
- •28. Оборудование стадии абсорбции нитрозных газов.
- •30.Методика расчета материального баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
- •34. Синтез карбамида: кинетика и параметры процесса. Диаграмма состояния системы.
- •35. Оборудование стадии синтеза карбамида. Расходные коэффициенты на 1 т карбамида. Технологические особенности производства карбамида.
- •36. Технологические схемы получения карбамида.
- •Вопрсо№39: Методика расчета материального баланса аппарата итн
- •Способы получения элементарной серы. Добыча серы. Требования к качеству серы.
- •Сырье для производства h2so4. Серный колчедан и др. Сернистые соединения металлов, газы цветной металлургии, сульфаты Ca, k, Fe.
- •Газы цветной металлургии
- •Физико-химические основы процесса горения серы. Печи для сжигания жидкой серы. Утилизация теплоты горения серы.
- •Методика расчета материального баланса циклонной печи.
- •Методика расчета теплового баланса циклонной печи.
- •47. Равновесие и кинетика процесса окисления диоксида серы
- •48. Катализаторы для окисления диоксида серы. Контактные аппараты для окисления диоксида серы.
- •49. Методика расчета материального баланса контактного аппарата
- •50. Методика расчета теплового баланса контактного аппарата
- •51.Равновесие и кинетика процесса абсорбции триоксида серы.
- •Аппаратурное оформление стадии абсорбции. Моногидратный абсорбер. Олеумный абсорбер, сушильная башня.
- •53.Методика расчета материального баланса моногидратного абсорбера.
- •55. Технологическая схема печного отделения.
- •56. Технологическая схема контактно-компрессорного отделения.
- •57. Технологическая схема сушильно-абсорбционного отделения.
- •58.Способы производства и применение фосфорной кислоты. Сырье и требования к качеству продукционной фосфорной кислоты. Стадии технологического процесса.
- •Разложение апатитового концентрата смесью серной и фосфорной кислот
- •Фильтрация фосфополугидрата на вакуумных фильтрах, гидроудаление
- •Упаривание (концентрирование) фосфорной кислоты
- •Абсорбция газов
- •59.Химизм процесса взаимодействия фосфатов с кислотами. Кинетика процесса разложения фосфатов.
- •Скорость процесса разложения фосфатов (Кинетика)
- •60.Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
- •61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
- •62.Выделение и улавливание фтора при получении и переработке эфк. Оборудование стадии.
- •63.Методика расчета материального баланса отделения экстракции в производстве дигидратной эфк.
- •64.Методика расчета теплового баланса отделения экстракции в производстве дигидратной эфк.
- •65. Производство сложных удобрений на основе эфк. Свойства фосфатов аммония. Физико-химические особенности производства аммофоса и фосфатов аммония.
- •Физико-химические особенности н а рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС. Взаимодействие эфк с nh3 происходит по реак-ям (1)-(3).
- •66 Вопрос. Основное оборудование стадий нейтрализации, гранулирования и сушки при получении фосфатов аммония: струйный реактор, саи, аг, сб, бгс.
- •68. Производство диаммонийфосфата, особенности технологии. Требования на даф
- •1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
- •8. Дать полную характеристику колонне синтеза, как реактору для получения карбамида. Материал колонны синтеза.
- •9. Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического хтп.
- •12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
- •13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
- •14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
- •15. Интенсификация работы оборудования и пути ее увеличения.
- •17.Охт. Дать полную характеристику экстрактору, как реактру для получения эфк.
31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
Ур-е ТБ: Q1+Q2+Q3+Q4+Q5=Q6+Q7+Q8+Q9, где Q1-физ. теп. нитрозного г. на вх. в к-ну (под тар. №1); Q2- т. р-ии гомоген. окисл-я NO до NO2; Q3-т. р-ии образ. НNO3 на тар.; Q4-т. разбавл. образ-ся моногидрата от 100% до 58%масс; Q5-ф. т. р-ра НNO3 поступ. на тар. №1 с тар. №2. Q6-ф. т. нитроз. Г. на вых. из тар. №1. Q7-ф. т. раст-ра НNO3 покид-го тар.№1; Q8-изб. т. передав-е оборот. воде; Q9-потери тепла в окр среду. Цели ТБ: Расчет всех потоков тепла, расчет расх. оборот. воды под-й в змеевики тар. и пов-ти змеевиков. Q1,Q5,Q6,Q7-выч-ся по форм. Q=nct, где n-кол-во в-ва(потока), кмоль; c- сред. мольная теплоем. потока при t, кДж/моль К; t-t потока С. Теплоемк-ь смеси выч-я по з-ну аддитивности, исп-я справ. дан. по сред. мол. «с» в-в вход.в см., либо выч-ть по эмпирич-м зав-ям с=f(t). Q2,Q3,Q4 -теплоты р-ии, разбавл. выч. по форм. Q=nq где n-кол-во прореаг-го в-ва, кмоль; q- мольная тепл-а р-ии либо мольная т-та разбавл., кДж/моль; Q9-потери т. в окр. ср. прин. = в размере 0,4% от прих. Т.; Q8-выч. из = приходной и расходной частей баланса. Расчет расх. оборот. воды проводят из соот-я Q8=Gвсв(tk-tн) где Gв –m воды, св –теплоемк. воды, 4,187кДж/(кг*К), tн,tk –Т соотв. нач. и кон.; Треб. поверх. змеевиков на тар. опр. из ур-я теплопер. Q=KFt. Необх. сделать 20% запас пов-ти. Коэф. теплопер., где 1-коэф. теплоотд. от к-ты к стенке, Вт/м2К; 2-коэф теплоотд. от стенки к воде, Вт/м2К; 1-толщ. стенки трубки, м; 2-толщ. накипи на стенке трубки, приним. = 0,0005 м; 1- коэф теплопров-ти мат-ла трубок, Вт/мК; 1- коэф теплопровод. накипи, Вт/мК. Коэф. теплоотд. и теплопровод. Рас-ся, или приним. на основе справ. дан..

32. Селективная каталитическая очистка хвостовых газов от оксида азота. Технологическое оформление процесса в виде технологического узла. Роль камеры сгорания реактора и камерысгорания турбинытурбины.Достоинства селективной очистки по сравнению с неселективной очисткой. Рекуперация энергии очищенных газов.
Содержание NОх в газе на выходе из абсорбционной колонны 0,09-0,11% об. Санитарная норма при выбросе в атмосферу 0,005% об, содержание в хвостовых газах 2,4-3,5% об. Для обезвреживания газа используют методы каталитического восстановления NОх природным газом или аммиаком до N2 и H2O. Процессы восстановления делят на высокотемпературные более 500С и низко менее 500С. При высокотемпературной неселективной каталитической очистке с использованием ПГ идут р-и:
СH4+2O2=CO2+2H2O, ΔН= -802 кДж (1). 4NO+CH4=2N2+CO2+2H2O, ΔН= -1165 кДж (2).
2NO2+CH4=N2+CO2+2H2O, ΔН<0 кДж (3). В начале идет р-я (1), а после полного израсходования кислорода идет (2 и 3). Селективная низкотемпературная каталитическая очистка с помощью NH3 идет при 230-320С: 6NO+4NH3=5N2+6H2O, ΔН= -1810.6 кДж (4). 6NO2+8NH3=7N2+12H2O, ΔН= -2734 кДж (5). Для селективного восстановления в качестве катализатора испытаны различные металлы. Каталитическая активность катализаторов процесса при 230-320С и скорости 10000 ч-1, убывает в последовательности: Pt>MnO2>V2O5>CuO>…>NiO>Ag2O>ZnO. Pt резко снижает свою активность в ходе процеса. Долгой активностью обладают оксиды Мn,V,Cu,Fe.Cr,Co. В нашей стране используется АВК-10М (V-10%). Процессы очистки на нем характеризуют: объемную скорость газа до 15000ч-1; линейную скорость газа до 1 м/с; отношение NH3:NОх = 1,1-1,15:1; степень восстановления NОх – 98-98,5%; время пробега катализатора 2-3года; остаточное содержание NОх в газе 0,002-0,004%об; NH3-не более 0,01% об. Достоинства селективной каталитической очистки: меньший расход аммиак по сравнению с ПГ, т к ПГ тратится по р-и (1); меньше температура процесса 250-300С против 690-730С (неселективной каталитической очистки). Недостатки селективной очистки с помощью аммиака: трудно точно дозировать небольшие объемы аммиака в хвостовых газах; сложно равномерно распределять аммиак в газовом потоке; возможно образование взрывоопасных нитрит-нитратов аммония в тр-дах; повышенная нагрузка на камеру сгорания турбины, т к газ смесь на входе в турбину должна иметь 670-700С. для предотвращения отложения солей температуру газа, выбрасываемых в атмосферу после турбины поддерживают выше 180С.
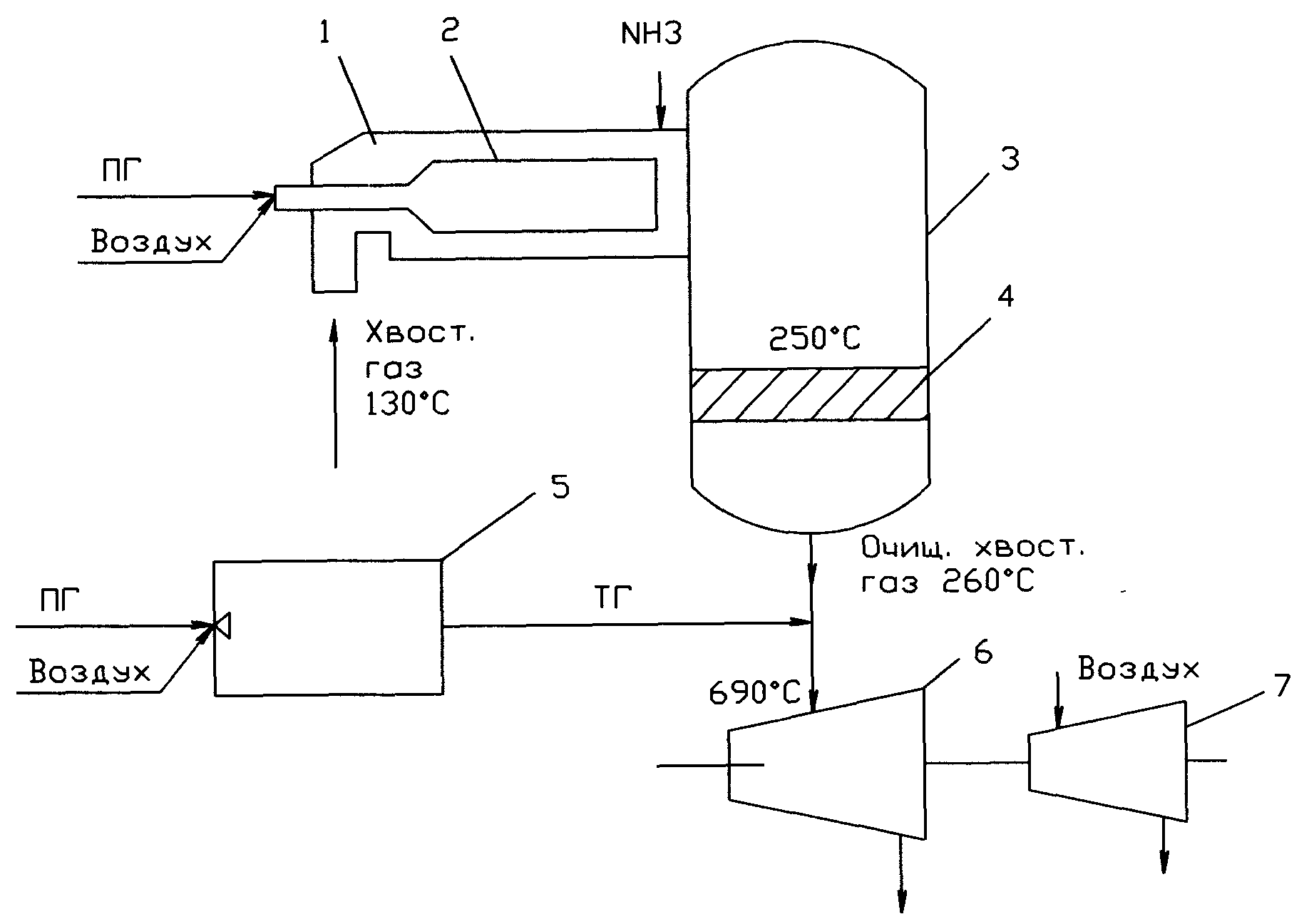
1 – камера сгорания реактора (КСР); 2 – жаровая часть КСР; 3 – реактор каталитической очистки (РКО); 4 – катализатор АВК – 10М; 5 – камера сгорания турбины (КСТ); 6 – турбина; 7 – компрессор воздуха.
КСР служит для того, чтобы нагреть ХГ до температуры зажигания кататилатора, равной 250 0С. Для этого топочные газы, образуются в огневой части КСР добавляются к ХГ, имеющие температуру примерно 1300С. Аммиак, используемый в качестве восстановителя имеет температуру пример 1000С. На алюмо-ванадиевом катализаторе в РКО протекает следующие реакции: 6NO + 4NH3 = 5N2 + 6H2O, ΔH = - 1811; 6NO2 + 8NH3 = 7N2 + 12H2O, ΔH = - 2734. В результате такого адиабатного режима температура ОХГ на выходе равна 2600С, объемная доля NОх в ОХГ 0,003%об. Однако температура газа на входе в турбину 6 должна составлять 7000С, поэтому к ОХГ добавляются горячие топочные газы из КСТ 5. Объем топочных газов значителен, это служит причиной того, что в КСТ при температурах горения выше 13000С генерируются так называемые ''термические'' NОх из N2 и О2 воздуха: N2 + О2 ↔ 2 NO, Н>0. Термический NОх добавляется к оксидам азота, присутствующем в ОХГ, в результате концентрация NОх в газе на входе в турбину повышается до 0,007%об и с такой концентрацией выбрасывается в атмосферу.
