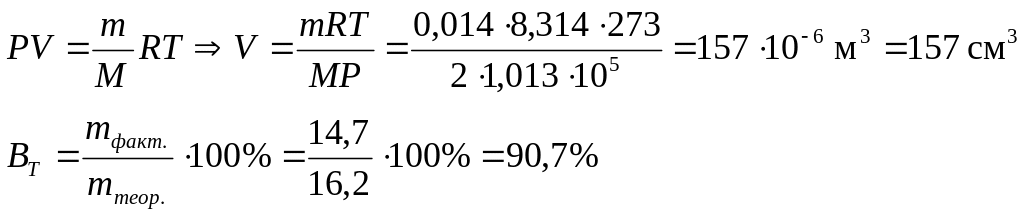- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •Теплоемкость газов
- •Теплоемкость твердых тел
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •Закон Гесса
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •Анализ уравнения (1.5):
- •1.1.8 Примеры решения задач
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •Характеристика энтропии
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определение константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ.
- •1.3.7 Примеры решения задач
- •Решение
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •Однокомпонентные системы
- •Равновесие между конденсированными и газообразными фазами
- •Примеры решения задач.
- •Двухкомпонентные системы
- •2.4.1 Термический анализ как часть физико-химического анализа
- •2.4.2 Равновесие раствор – кристаллический компонент
- •2.4.3 Кривые охлаждения
- •2.4.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.4.5 Определение состава фаз и относительного количества фаз
- •2.4.6 Диаграмма состояния системы с устойчивым химическим соединением
- •2.4.7 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.4.8 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.5 Твердые растворы
- •2.5.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.5.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •2. Диаграмма с перитектическим превращением
- •2.5.3 Примеры разбора диаграмм
- •План разбора диаграммы двухкомпонентной системы
- •3Растворы
- •3.1 Теоретические понятия
- •Способы выражения состава раствора
- •3.2 Закон Рауля. Идеальные растворы
- •3.3 Следствия из закона Рауля
- •3.3.1 Повышение температуры кипения идеального раствора
- •3.3.2 Понижение температуры замерзания раствора
- •3.4 Реальные растворы
- •3.4.1 Отклонения от закона Рауля
- •3.4.2 Активность. Коэффициент активности
- •Общее давление и состав пара и жидкости. Законы Коновалова
- •3.6 Разделение бинарных смесей путем перегонки
- •3.7 Равновесие «жидкость - пар» для практически несмешивающихся жидкостей
- •3.8 Осмотическое давление
- •3.8 Закон распределения Нернста. Экстракция
- •3.9 Примеры решения задач
- •Электрохимия электрическая проводимость растворов электролитов
- •1 Сильные и слабые электролиты
- •Электрическая проводимость
- •2.1 Удельная электрическая проводимость
- •2.2 Молярная и эквивалентная электрические проводимости
- •3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •Электродные процессы
- •Классификация электродов
- •Типы гальванических элементов
- •Диффузионный потенциал
- •Потенциометрическое титрование
- •Электролиз
- •Кинетика
- •Скорость химической реакции
- •Кинетическая классификация химических реакций
- •Молекулярность реакции
- •Порядок реакции
- •Реакции первого порядка
- •Реакции второго порядка
- •Влияние температуры на скорость реакции. Энергия активации
- •Методы определения порядка реакции
- •Метод подстановки
- •Графический метод
- •Метод начальных скоростей
- •Метод избытка (метод Вант - Гоффа)
- •5 Метод нахождения общего порядка реакции
- •Метод по доле непревращенного вещества к моменту времени t
Электролиз
Электролиз – это процессы, протекающие на электродах при пропускании электрического тока через растворы или расплавы электролитов.
Фарадеем установлены количественные законы электролиза.
Первый закон: количество прореагировавшего при электролизе вещества пропорционально количеству прошедшего через раствор электричества:
![]()
где m – масса вещества; Q - количество электричества; К – электрохимический эквивалент.
![]() ;
;
![]()
где i- плотность тока; S – площадь; t – время, с; М – молярная масса; F – число Фарадея, 96485 Кл; n – число электронов участвующих в электродной реакции.
Второй закон: при определенном количестве прошедшего электричества отношение масс прореагировавших веществ равно отношению их химических эквивалентов, Э:
![]()
![]()
Задача 1
Вычислить ЭДС элемента, составленного из хлорсеребряного электрода в растворе НСl (С = 0,01 моль/л), с учетом диффузионного потенциала при 25 0С.
Дано:

Решение:
Составляем гальваническую цепь из газового электрода, и электрода второго рода. Определяем знаки электродов из сравнения значений . Записываем реакции на электродах согласно их знакам:
(-) Pt, H2 | HCl || HCl | AgCl, AgCl (+)
= 0 = 0,222 В
С2 = 0,50 С1= 0,01
Н2 – 2е → 2Н+ 2AgCl + 2e → 2Ag+ + 2Cl-

Это значение ЭДС без учета диффузионного потенциала.
В данном случае
![]() возникает на границе двух растворов
электролитов одинаковых по химической
природе, но с различными концентрациями.
возникает на границе двух растворов
электролитов одинаковых по химической
природе, но с различными концентрациями.
![]()
Полученная величина
- значение
![]() по модулю.
по модулю.
Для определения
знака
рассмотрим направление электрического
поля на границе растворов (см. гальваническую
цепь). Поскольку С2
> С1,
диффузия HCl
будет идти слева направо, при этом ионы
Н+,
имеющие большую подвижность,
![]() ,
будут опережать ионы, Сl-,
образуя двойной электрический слой
(ДЭС) на границе растворов с положительной
правой обкладкой (см. цепь) и отрицательной
левой. Таким образом, направление поля
ДЭС и направление поля электродов
совпадает и
,
будут опережать ионы, Сl-,
образуя двойной электрический слой
(ДЭС) на границе растворов с положительной
правой обкладкой (см. цепь) и отрицательной
левой. Таким образом, направление поля
ДЭС и направление поля электродов
совпадает и
![]() .
.
![]()
Задача 2.
Рассчитать диффузионный потенциал гальванической цепи и определить его знак.
(-) Hg, Hg2Cl2 | KCl CuSO4 | Cu (+)
если СКСl = 0,01, CCuSO4 = 0,01 моль/л.
Справочные данные:

Решение:
Поскольку граничащие растворы различаются по химической природе, а их концентрации одинаковы, то расчет производится по формуле:
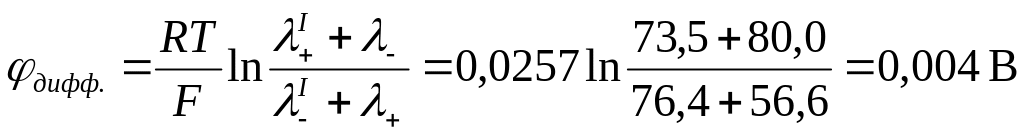
Определим знак .
Так как концентрация
обоих электролитов одинакова, то диффузия
ионов будет происходить и слева направо
и справа налево. Движение К+
и Сu2+
происходит в противоположных направлениях,
но у К+
подвижность больше на
![]() и с правой стороны границы накапливается
положительный заряд. При движении Сl-
и SO42-
и с правой стороны границы накапливается
положительный заряд. При движении Сl-
и SO42-
![]() ,
то есть за счет большей подвижности
SO42-,
слева накапливается отрицательный
заряд, но
,
то есть за счет большей подвижности
SO42-,
слева накапливается отрицательный
заряд, но
![]() ,
что дает в итоге положительный потенциал
справа,
. Направление полей ДЭС и
электродов совпадает,
.
,
что дает в итоге положительный потенциал
справа,
. Направление полей ДЭС и
электродов совпадает,
.
Задача 3.
При электролизе
раствора, содержащего Pb2+
, через 70 минут на поверхности 1,2 дм2
получено покрытие толщиной 108 мкм при
плотности тока 3,0 А/дм2.
При этом выделилось некоторое количество
водорода. Рассчитать выход по току для
свинца и объем выделившегося водорода
при н.у.,
![]() .
.
Дано:
t = 70 мин = 4200 с
S = 1,2 дм2
h = 108 мкм = 108·10-5 дм
i = 3,0 А/дм2
![]() = 11,34 кг/дм3
= 11,34 кг/дм3
ВТ (Pb)-?
![]() - ?
- ?
Решение
![]()
По I
закону Фарадея:
![]()
![]()
Фактическая масса
свинца меньше теоретической за счет
того, что часть количества электричества
расходуется на восстановление водорода.
Недополученное количество свинца равно
16,2 – 14,7 = 1,5 г. Вместо него выделился
водород, масса которого может быть
рассчитана по второму закону Фарадея:
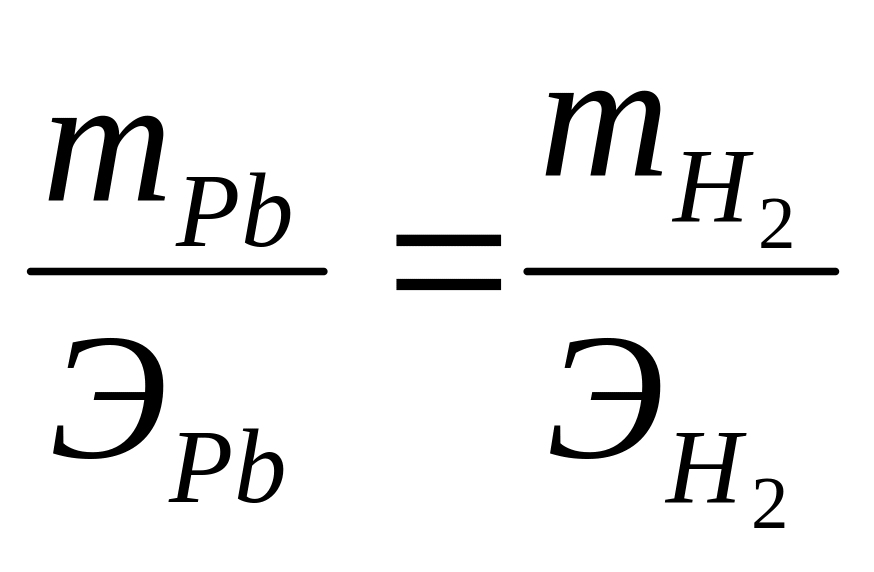 ;
;
![]()
Объем водорода при нормальных условиях (Р = 1 атм., Т = 273 К) определяется по уравнению идеального газового состояния: