- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •Теплоемкость газов
- •Теплоемкость твердых тел
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •Закон Гесса
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •Анализ уравнения (1.5):
- •1.1.8 Примеры решения задач
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •Характеристика энтропии
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определение константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ.
- •1.3.7 Примеры решения задач
- •Решение
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •Однокомпонентные системы
- •Равновесие между конденсированными и газообразными фазами
- •Примеры решения задач.
- •Двухкомпонентные системы
- •2.4.1 Термический анализ как часть физико-химического анализа
- •2.4.2 Равновесие раствор – кристаллический компонент
- •2.4.3 Кривые охлаждения
- •2.4.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.4.5 Определение состава фаз и относительного количества фаз
- •2.4.6 Диаграмма состояния системы с устойчивым химическим соединением
- •2.4.7 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.4.8 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.5 Твердые растворы
- •2.5.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.5.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •2. Диаграмма с перитектическим превращением
- •2.5.3 Примеры разбора диаграмм
- •План разбора диаграммы двухкомпонентной системы
- •3Растворы
- •3.1 Теоретические понятия
- •Способы выражения состава раствора
- •3.2 Закон Рауля. Идеальные растворы
- •3.3 Следствия из закона Рауля
- •3.3.1 Повышение температуры кипения идеального раствора
- •3.3.2 Понижение температуры замерзания раствора
- •3.4 Реальные растворы
- •3.4.1 Отклонения от закона Рауля
- •3.4.2 Активность. Коэффициент активности
- •Общее давление и состав пара и жидкости. Законы Коновалова
- •3.6 Разделение бинарных смесей путем перегонки
- •3.7 Равновесие «жидкость - пар» для практически несмешивающихся жидкостей
- •3.8 Осмотическое давление
- •3.8 Закон распределения Нернста. Экстракция
- •3.9 Примеры решения задач
- •Электрохимия электрическая проводимость растворов электролитов
- •1 Сильные и слабые электролиты
- •Электрическая проводимость
- •2.1 Удельная электрическая проводимость
- •2.2 Молярная и эквивалентная электрические проводимости
- •3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •Электродные процессы
- •Классификация электродов
- •Типы гальванических элементов
- •Диффузионный потенциал
- •Потенциометрическое титрование
- •Электролиз
- •Кинетика
- •Скорость химической реакции
- •Кинетическая классификация химических реакций
- •Молекулярность реакции
- •Порядок реакции
- •Реакции первого порядка
- •Реакции второго порядка
- •Влияние температуры на скорость реакции. Энергия активации
- •Методы определения порядка реакции
- •Метод подстановки
- •Графический метод
- •Метод начальных скоростей
- •Метод избытка (метод Вант - Гоффа)
- •5 Метод нахождения общего порядка реакции
- •Метод по доле непревращенного вещества к моменту времени t
3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
Непосредственное
экспериментальное измерение
невозможно. Для растворов сильных
электролитов наиболее пригоден метод
экстраполяции, с использованием уравнение
(10). Для этого найденные значения
наносят на график в виде функции от
![]() Полученная прямая экстраполируется до
С = 0, и отрезок на оси ординат даст
.
Полученная прямая экстраполируется до
С = 0, и отрезок на оси ординат даст
.
В случае слабых электролитов хорошие результаты дает способ, основанный на применении закона Кольрауша, уравнение (8), по для сильных электролитов. Например, для уксусной кислоты типичного слабого электролита,
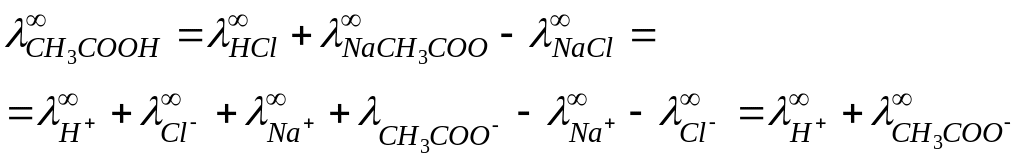
Величины
![]() определяются методом экстраполяции.
определяются методом экстраполяции.
Кондуктометрическое титрование
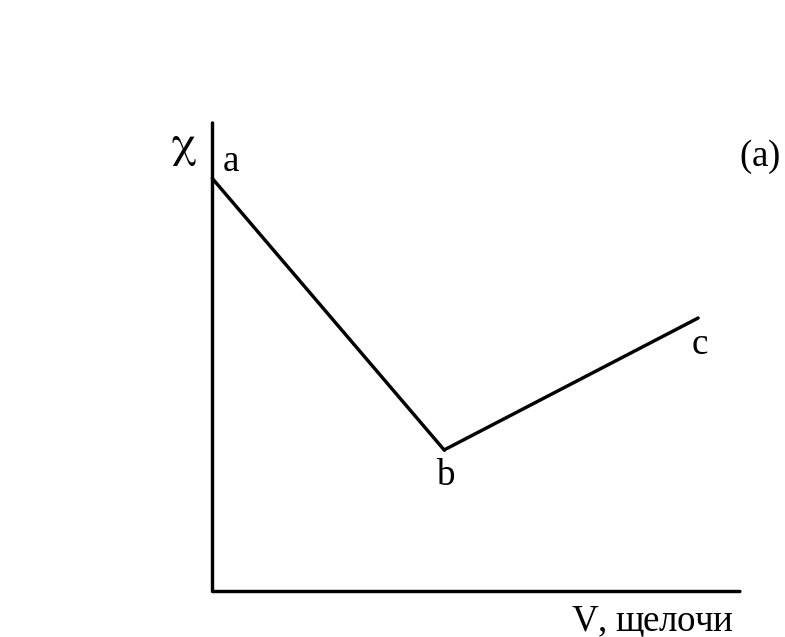
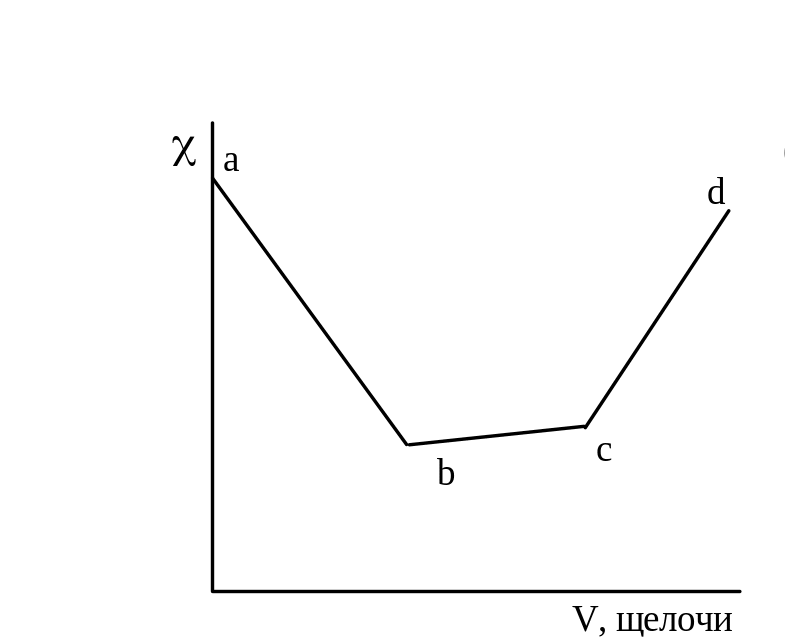
Это один из физико–химических методов анализа, основанный на измерении электропроводности системы. Он с успехом применяется в случаях, когда между анализируемым раствором и титрантом могут протекать обменные ионные или окислительно – восстановительные реакции, в результате которых изменяется электропроводящая способность раствора. Зависимость электрической проводимости раствора от объема добавляемого титранта изображают графически. Полученный график называется кривой кондуктометрического титрования. Кривые имеют излом, соответствующий точке эквивалентности.
На рисунке 3.1 даны примеры кривых титрования сильной кислоты (а) и смеси слабой и сильной кислот (б) сильной щелочью. В ходе титрования объем раствора не должен значительно изменяться, для чего концентрация титранта должна быть значительно выше концентрации титруемого раствора.
|
|
Рисунок 3.1 – График кондуктометрического титрования сильной кислоты (а) и смеси сильной и слабой кислот (б) сильным основанием.
Следует отметить, что подвижность ионов Н+ и ОН- является анамально высокой посравнению с другими ионами.
При титровании сильной кислоты щелочью (а) сначала происходит снижение электрической проводимости раствора за счет замены подвижного иона водорода менее подвижным катионом металла (участок ав). При добавлении к системе после точки эквивалентности избытка щелочи электрическая проводимость растет за счет появления ионов ОН- (свободной щелочи).
При титровании
слабой кислоты (например, СН3СООН)
щелочью (NaOH)
малая электропроводность кислоты растет
за счет появления свободных ионов соли
(сильного электролита). После точки
эквивалентности в системе появляются
избыточные ионы ОН-,
имеющие большую подвижность (![]()
![]()
![]()
![]() ),
что приводит к резкому возрастанию
электропроводности. Этому случаю
отвечают линии «ав» и «сd»
на рисунке 3.1 б.
),
что приводит к резкому возрастанию
электропроводности. Этому случаю
отвечают линии «ав» и «сd»
на рисунке 3.1 б.
При титровании смеси кислот сначала оттитровывается сильная кислота (участок ав), а затем начинается нейтрализация слабой, малодиссоциированной кислоты. При этом образуется хорошо диссоциированная соль, что приводит к повышению (участок вс) до точки эквивалентности (с).
Дальнейшее приливание избытка щелочи приводит к более резкому возрастанию за счет ионов ОН- щелочи.
Этим методом можно проводить титрование солей, если выпадает осадок, понижающий концентрацию ионов, обусловливающих электропроводность раствора, например, при титровании MgSO4 раствором Ва(ОН)2:
MgSO4 + Ва(ОН)2 Mg(ОН)2 ↓ + Ва SO4 ↓
Задача 1
Константа диссоциации уксусной кислоты равна 1,8·10-5. Чему равен рН раствора, если к 1 л раствора кислоты (С = 1 моль/л) добавить 8,2·10-3 кг ацетата натрия? Считать, что объем раствора не изменится при добавлении соли.
Дано:
Кд = 1,8·10-5
Vраствора= 1 л
Скислоты = 1 моль/л
mсоли =8,2·10-3 кг
рН - ?
Решение
В системе имеется кислота, которая диссоциирует частично, и соль которая диссоциирует нацело.
СН3СООН СН3СОО- + Н+
до реакции 1 0 0
при равновесии 1-х х х
СН3СООNa СН3СОО- + Na+
до реакции 0,10 0 0
после дисоциации 0 0,10 0,10
![]() моль
моль
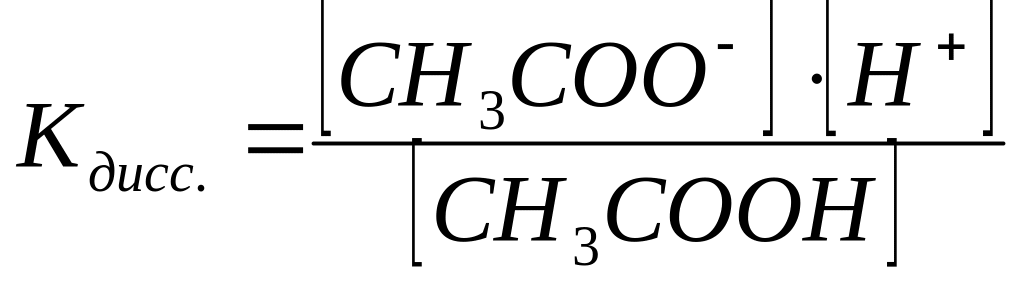
Ацетат ион, СН3СОО-,
образуется за счет диссоциации как
кислоты так и соли, т.е.
![]()
![]()
Поскольку электролит является слабым, то количество продиссоциированного электролита, х мало, и в алгебраических суммах им с небольшой погрешностью можно пренебречь. Тогда:
![]()
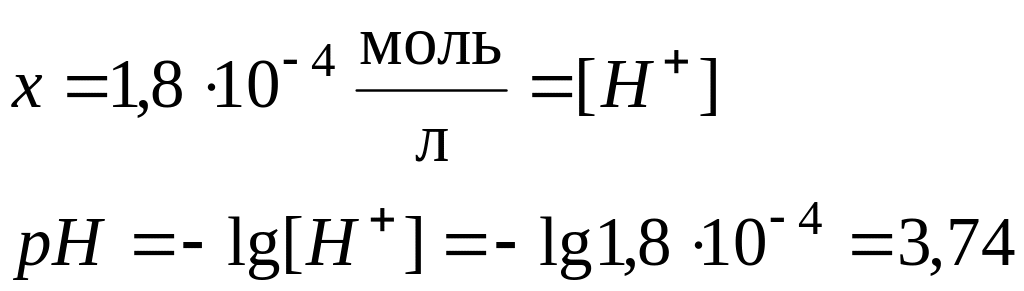
Задача 2
Предельная
электрическая проводимость водного
раствора NH4Cl
равна 130·10-4
![]() .
Подвижности ионов ОН-
и Cl-
соответственно равны 174·10-4
и 65,4·10-4
.
Подвижности ионов ОН-
и Cl-
соответственно равны 174·10-4
и 65,4·10-4
![]() .
Вычислить предельную электрическую
проводимость NH4ОН
и число переноса иона NH4+
в растворе NH4Cl
при бесконечном разведении.
.
Вычислить предельную электрическую
проводимость NH4ОН
и число переноса иона NH4+
в растворе NH4Cl
при бесконечном разведении.
Дано
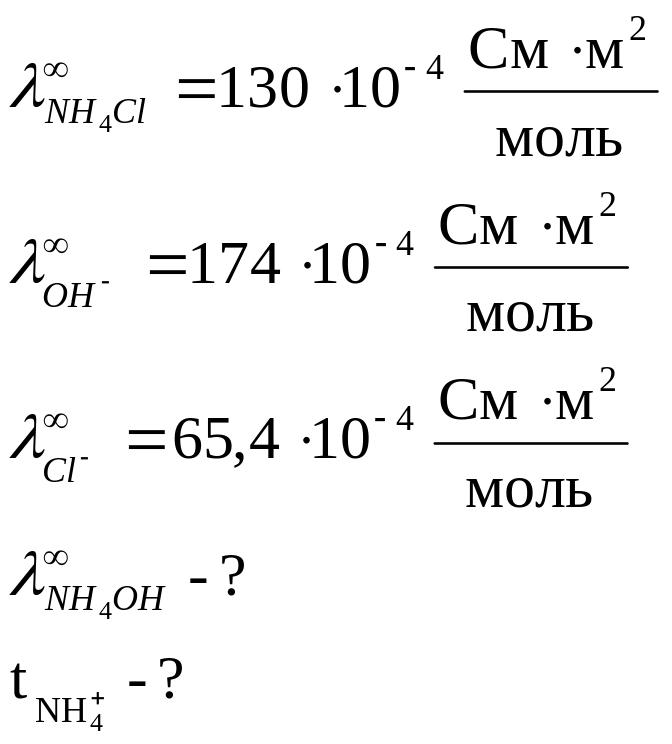
Решение:
Согласно
закону Кольрауша:
![]() .
.
Для
нахождения
![]() запишем закон Кольрауша для NH4Cl:
запишем закон Кольрауша для NH4Cl:
![]() откуда
откуда
![]() .
.
Таким образом,
![]()
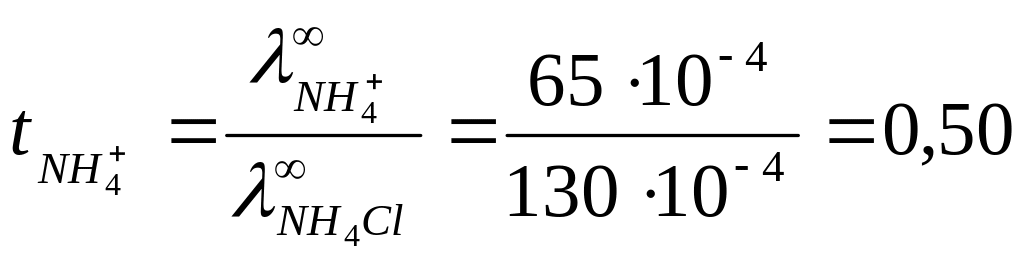
Задача 3
Определить теплоту диссоциации уксусной кислоты, если удельное сопротивление раствора кислоты с С = 0,01 моль/л, при 298 К равно 61,0 Ом·м, а при 288 К равно 83,7 83,7 Ом·м.
Дано:
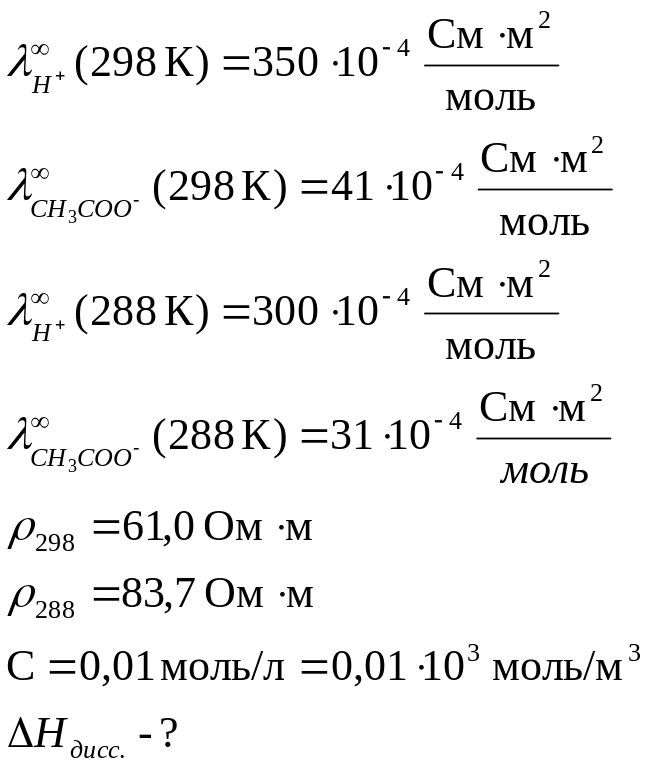
Решение:
Теплота реакции диссоциации кислоты определяется из уравнения изобары Вант Гоффа в интегральном виде:
![]()
Для решения надо рассчитать константы диссоциации при двух температурах, используя уравнения:
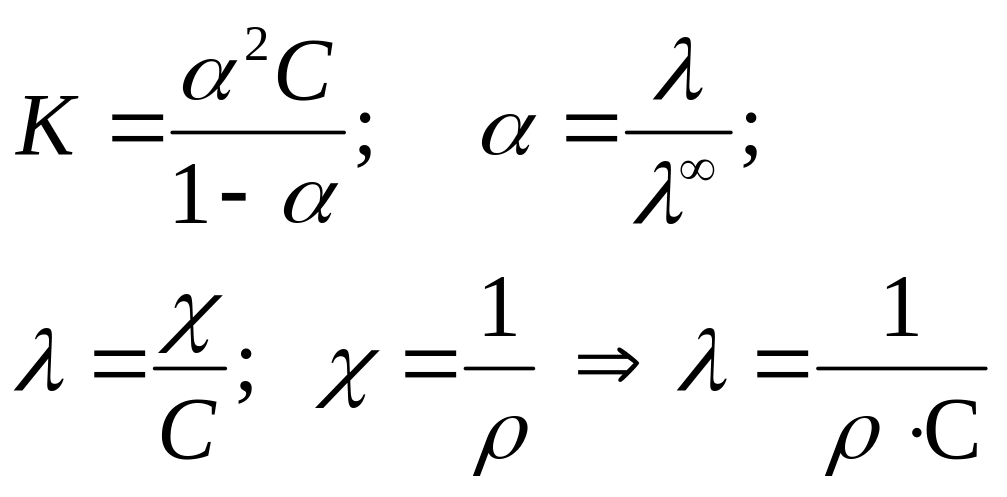
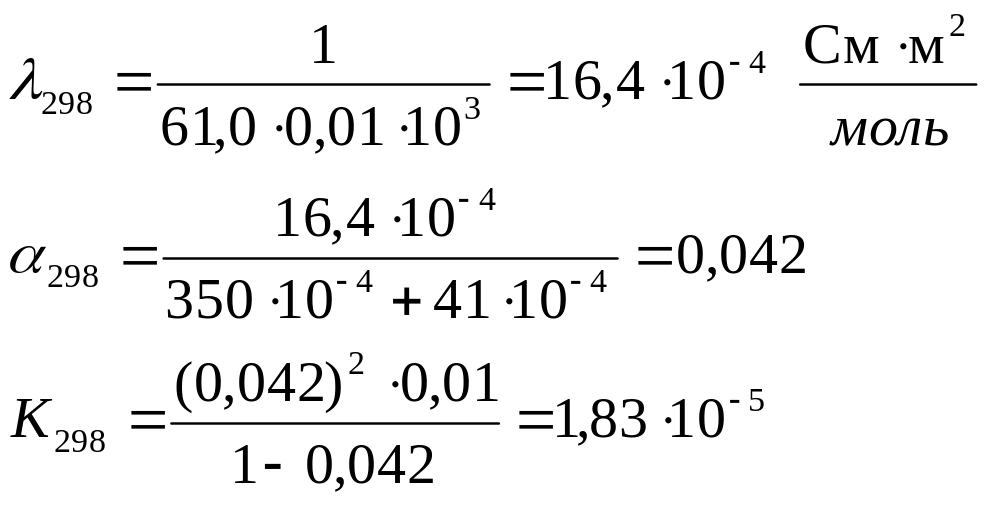
Аналогично рассчитываем для 288 К:
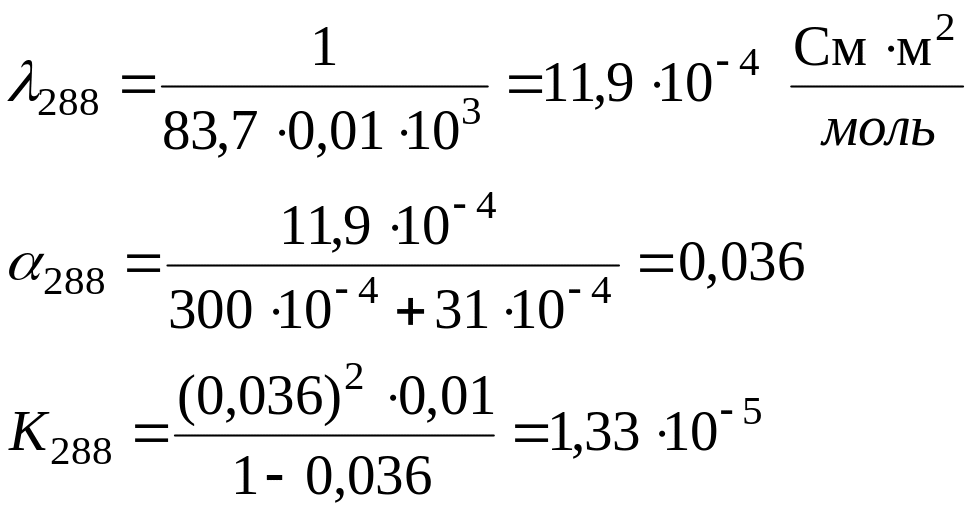
![]()