
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •Теплоемкость газов
- •Теплоемкость твердых тел
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •Закон Гесса
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •Анализ уравнения (1.5):
- •1.1.8 Примеры решения задач
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •Характеристика энтропии
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определение константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ.
- •1.3.7 Примеры решения задач
- •Решение
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •Однокомпонентные системы
- •Равновесие между конденсированными и газообразными фазами
- •Примеры решения задач.
- •Двухкомпонентные системы
- •2.4.1 Термический анализ как часть физико-химического анализа
- •2.4.2 Равновесие раствор – кристаллический компонент
- •2.4.3 Кривые охлаждения
- •2.4.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.4.5 Определение состава фаз и относительного количества фаз
- •2.4.6 Диаграмма состояния системы с устойчивым химическим соединением
- •2.4.7 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.4.8 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.5 Твердые растворы
- •2.5.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.5.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •2. Диаграмма с перитектическим превращением
- •2.5.3 Примеры разбора диаграмм
- •План разбора диаграммы двухкомпонентной системы
- •3Растворы
- •3.1 Теоретические понятия
- •Способы выражения состава раствора
- •3.2 Закон Рауля. Идеальные растворы
- •3.3 Следствия из закона Рауля
- •3.3.1 Повышение температуры кипения идеального раствора
- •3.3.2 Понижение температуры замерзания раствора
- •3.4 Реальные растворы
- •3.4.1 Отклонения от закона Рауля
- •3.4.2 Активность. Коэффициент активности
- •Общее давление и состав пара и жидкости. Законы Коновалова
- •3.6 Разделение бинарных смесей путем перегонки
- •3.7 Равновесие «жидкость - пар» для практически несмешивающихся жидкостей
- •3.8 Осмотическое давление
- •3.8 Закон распределения Нернста. Экстракция
- •3.9 Примеры решения задач
- •Электрохимия электрическая проводимость растворов электролитов
- •1 Сильные и слабые электролиты
- •Электрическая проводимость
- •2.1 Удельная электрическая проводимость
- •2.2 Молярная и эквивалентная электрические проводимости
- •3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •Электродные процессы
- •Классификация электродов
- •Типы гальванических элементов
- •Диффузионный потенциал
- •Потенциометрическое титрование
- •Электролиз
- •Кинетика
- •Скорость химической реакции
- •Кинетическая классификация химических реакций
- •Молекулярность реакции
- •Порядок реакции
- •Реакции первого порядка
- •Реакции второго порядка
- •Влияние температуры на скорость реакции. Энергия активации
- •Методы определения порядка реакции
- •Метод подстановки
- •Графический метод
- •Метод начальных скоростей
- •Метод избытка (метод Вант - Гоффа)
- •5 Метод нахождения общего порядка реакции
- •Метод по доле непревращенного вещества к моменту времени t
Электрическая проводимость
2.1 Удельная электрическая проводимость
Электрическая проводимость – способность веществ проводить электрический ток под действием внешнего электрического поля – величина, обратная электрическому сопротивлению L = 1/R
![]() [См]
[См]
где ρ
– удельное
сопротивление, Ом·м;
![]() - удельная электрическая проводимость,
См/м (сименс/метр); S
– поперечное сечение, м2;
l
– длина
проводника, м.
- удельная электрическая проводимость,
См/м (сименс/метр); S
– поперечное сечение, м2;
l
– длина
проводника, м.
Единица измерения L – сименс (См), 1 См = 1 Ом-1
Удельная электрическая проводимость раствора характеризует проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга. Единица измерения в системе СИ См·м-1.
Удельная проводимость раствора электролита определяется количеством ионов, переносящих электричество и скоростью их миграции:
![]()
где α
– степень диссоциации электролита; С
– молярная концентрация эквивалента,
моль/м3
или моль/л; F
– число
Фарадея, 96485 Кл/г-экв;
![]() - абсолютные скорости движения катиона
и аниона – скорости при градиенте
потенциала поля, равном 1, В/м;
- абсолютные скорости движения катиона
и аниона – скорости при градиенте
потенциала поля, равном 1, В/м;
Единица измерения χ - м2В-1с-1.
Из уравнения ( ) следует, что зависит от концентрации как для сильных так и для слабых электролитов (рисунок ):
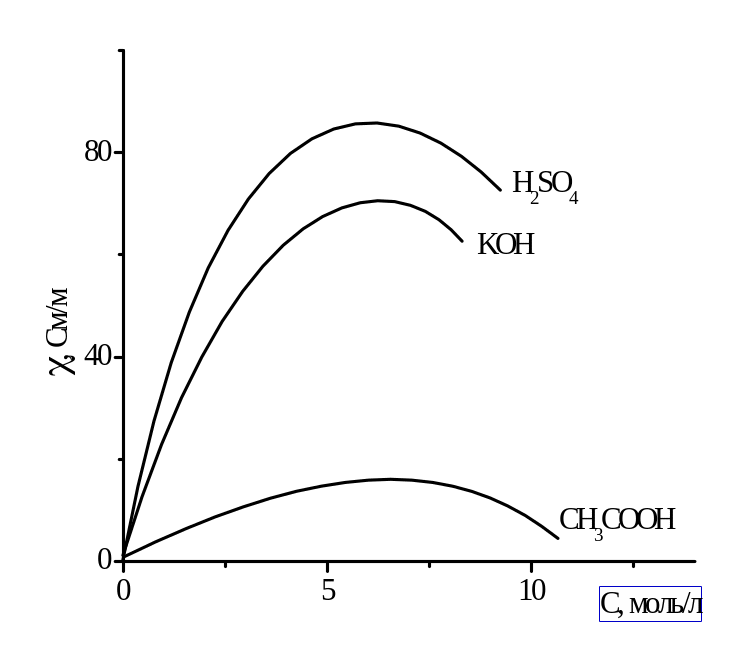
Рисунок 2.1 – Зависимость удельной электрической проводимости от концентрации в водных растворах.
В разбавленных растворах при С → 0 стремится к удельной электропроводности воды, которая составляет около 10-6 См/м и обусловлена присутствием ионов Н3О+ и ОН-. С ростом концентрации электролита, вначале увеличивается, что отвечает увеличению числа ионов в растворе. Однако, чем больше ионов в растворе, тем сильнее проявляется ионное взаимодействие, приводящее к уменьшению скорости движения ионов. Кроме того, у слабых электролитов в концентрированных растворах заметно снижается степень диссоциации и, следовательно, количество ионов, переносящих электричество. Поэтому почти всегда зависимость удельной электрической проводимости от концентрации электролита проходит через максимум.
2.2 Молярная и эквивалентная электрические проводимости
Чтобы выделить
эффекты ионного взаимодействия, удельную
электрическую проводимость
делят на молярную концентрацию С
(моль/м3),
и получают молярную электрическую
проводимость
![]() ,
или делят на молярную концентрацию
эквивалента и получают эквивалентную
проводимость
,
или делят на молярную концентрацию
эквивалента и получают эквивалентную
проводимость
![]() .
.
Единицей измерения
![]() является м2См/моль.
Физический смысл
состоит в следующем: она численно равна
электрической проводимости раствора,
заключенного между двумя параллельными
электродами, расположенными на расстоянии
1 м и имеющими такую площадь, что объем
раствора между электродами содержит
один моль эквивалента растворенного
вещества (в случае молярной электрической
проводимости – один моль растворенного
вещества). Таким образом, в случае
эквивалентной электрической проводимости
в этом объеме будет NА
положительных и NА
отрицательных зарядов для раствора
любого электролита при условии его
полной диссоциации (NА
– число Авагадро). Поэтому, если бы ионы
не взаимодействовали друг с другом, то
сохранялась бы постоянной при всех
концентрациях. В реальных системах
зависит от концентрации (рисунок 2.2).
При С → 0,
является м2См/моль.
Физический смысл
состоит в следующем: она численно равна
электрической проводимости раствора,
заключенного между двумя параллельными
электродами, расположенными на расстоянии
1 м и имеющими такую площадь, что объем
раствора между электродами содержит
один моль эквивалента растворенного
вещества (в случае молярной электрической
проводимости – один моль растворенного
вещества). Таким образом, в случае
эквивалентной электрической проводимости
в этом объеме будет NА
положительных и NА
отрицательных зарядов для раствора
любого электролита при условии его
полной диссоциации (NА
– число Авагадро). Поэтому, если бы ионы
не взаимодействовали друг с другом, то
сохранялась бы постоянной при всех
концентрациях. В реальных системах
зависит от концентрации (рисунок 2.2).
При С → 0,
![]() → 1, величина
стремится к
→ 1, величина
стремится к
![]() ,
отвечающей отсутствию ионного
взаимодействия. Из уравнения (5) следует:
,
отвечающей отсутствию ионного
взаимодействия. Из уравнения (5) следует:
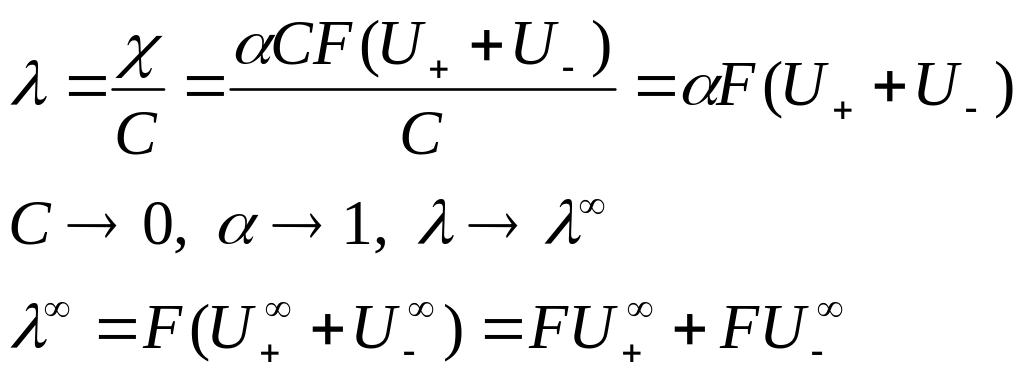
Произведение
![]() называют предельной
эквивалентной
электрической проводимостью ионов, или
предельной подвижностью
ионов:
называют предельной
эквивалентной
электрической проводимостью ионов, или
предельной подвижностью
ионов:
![]() (8)
(8)
Соотношение (8) установлено Кольраушем и называется законом независимого движения ионов. Предельная подвижность является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры. Уравнение (8) для молярной электрической проводимости принимает вид:
![]()
где
![]() - число эквивалентов катионов и анионов,
необходимых для образования 1 моль соли.
- число эквивалентов катионов и анионов,
необходимых для образования 1 моль соли.
Пример:
![]()
В случае одновалентного
электролита, например, HCl,
![]() ,
то есть молярная и эквивалентная
электрические проводимости совпадают.
,
то есть молярная и эквивалентная
электрические проводимости совпадают.
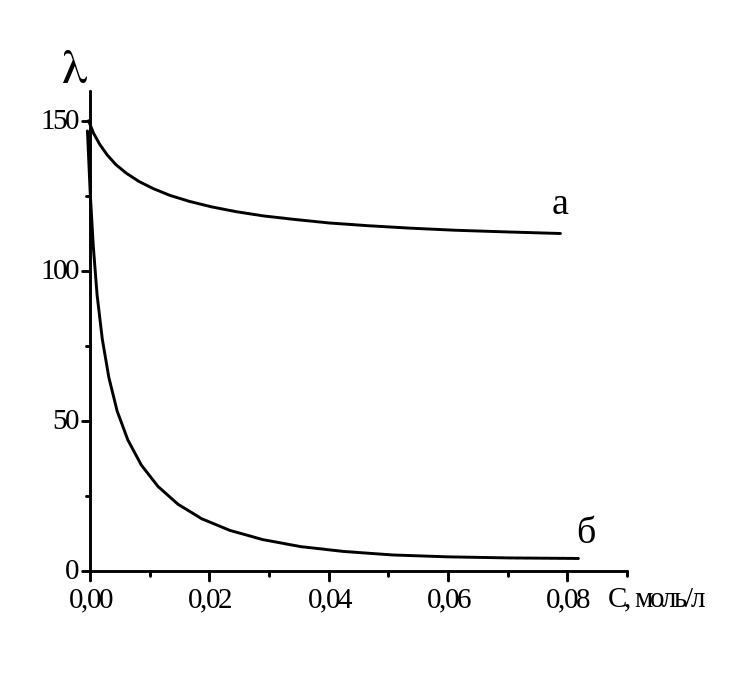
Рисунок 2.2 – Зависимость эквивалентной электропроводности от концентрации для сильных (а) и слабых (б) электролитов.
Для растворов слабых электролитов эквивалентная электрическая проводимость остается небольшой вплоть до очень низких концентраций, по достижении которых она резко поднимается до значений, сравнимых с сильных электролитов. Это происходит за счет увеличения степени диссоциации, которая, согласно классической теории электролитической диссоциации, растет с разбавлением и в пределе стремится к 1.
Степень диссоциации можно выразить, разделив уравнение (6) на (7):
![]()
С увеличением концентрации растворов сильных электролитов уменьшается, но незначительно. Кольрауш показал, что таких растворов при невысоких концентрациях подчиняется уравнению:
![]()
где А – постоянная, зависящая от природы растворителя, температуры и валентного типа электролита.
По теории Дебая – Онзагера снижение эквивалентной электрической проводимости растворов сильных электролитов связано с уменьшением скоростей движения ионов за счет двух эффектов торможения движения ионов, возникающих из-за электростатистического взаимодействия между ионом и его ионной атмосферой. Каждый ион стремится окружить себя ионами противоположного заряда. Облако заряда называют ионной атмосферой, и в среднем оно сферически симметрично. Первый эффект – эффект электрофоретического торможения. При наложении электрического поля ион движется в одну сторону, а его ионная атмосфера – в противоположную. Но с ионной атмосферой за счет гидратации ионов атмосферы увлекается часть растворителя, и центральный ион при движении встречает поток растворителя, движущегося в противоположном направлении, что создает дополнительное вязкостное торможение иона.
Второй эффект – релаксационного торможения. При движении иона во внешнем поле атмосфера должна исчезать позади иона и образовываться впереди него. Оба эти процесса происходят не мгновенно. Поэтому впереди иона количество ионов противоположного знака меньше, чем позади, то есть облако становится несимметричным, центр заряда атмосферы смещается назад, и поскольку заряды иона и атмосферы противоположны, движение иона замедляется. Силы релаксационного и электрофоретического торможения определяются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита при прочих постоянных условиях эти силы возрастают с увеличением концентрации раствора.
Определение растворимости труднорастворимой соли
По величине удельной электрической проводимости насыщенного раствора труднорастворимой соли можно найти ее концентрацию, а следовательно, вычислить растворимость и произведение растворимости. Поскольку в насыщенном растворе такой соли концентрация очень мала, его эквивалентная электрическая проводимость совпадает с тогда из уравнения (6) получаем:
![]()
Ввиду малой удельной электрической проводимости раствора необходимо вводить поправку на воды, поэтому:
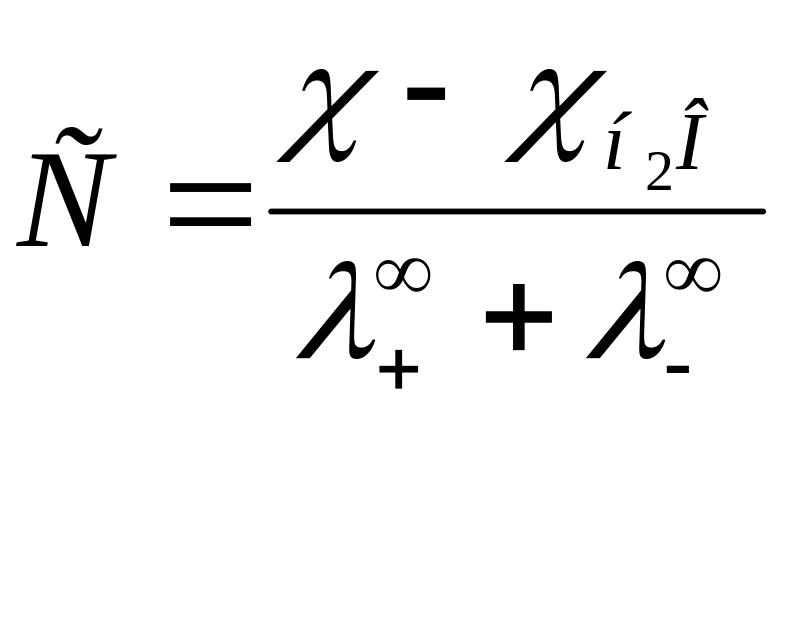
Если электролит одновалентный, то произведение растворимости, равное произведению активностей ионов в насыщенном растворе, будет равно (с некоторым приближением):
![]()
Для более сложных электролитов произведение растворимости находится аналогично, но с учетом диссоциации электролита.
Так для соли Ag2S с молярной концентрацией С (моль/л):
Ag2S
![]() 2Ag+
+ S2-
2Ag+
+ S2-
![]()
