
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •Теплоемкость газов
- •Теплоемкость твердых тел
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •Закон Гесса
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •Анализ уравнения (1.5):
- •1.1.8 Примеры решения задач
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •Характеристика энтропии
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определение константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ.
- •1.3.7 Примеры решения задач
- •Решение
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •Однокомпонентные системы
- •Равновесие между конденсированными и газообразными фазами
- •Примеры решения задач.
- •Двухкомпонентные системы
- •2.4.1 Термический анализ как часть физико-химического анализа
- •2.4.2 Равновесие раствор – кристаллический компонент
- •2.4.3 Кривые охлаждения
- •2.4.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.4.5 Определение состава фаз и относительного количества фаз
- •2.4.6 Диаграмма состояния системы с устойчивым химическим соединением
- •2.4.7 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.4.8 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.5 Твердые растворы
- •2.5.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.5.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •2. Диаграмма с перитектическим превращением
- •2.5.3 Примеры разбора диаграмм
- •План разбора диаграммы двухкомпонентной системы
- •3Растворы
- •3.1 Теоретические понятия
- •Способы выражения состава раствора
- •3.2 Закон Рауля. Идеальные растворы
- •3.3 Следствия из закона Рауля
- •3.3.1 Повышение температуры кипения идеального раствора
- •3.3.2 Понижение температуры замерзания раствора
- •3.4 Реальные растворы
- •3.4.1 Отклонения от закона Рауля
- •3.4.2 Активность. Коэффициент активности
- •Общее давление и состав пара и жидкости. Законы Коновалова
- •3.6 Разделение бинарных смесей путем перегонки
- •3.7 Равновесие «жидкость - пар» для практически несмешивающихся жидкостей
- •3.8 Осмотическое давление
- •3.8 Закон распределения Нернста. Экстракция
- •3.9 Примеры решения задач
- •Электрохимия электрическая проводимость растворов электролитов
- •1 Сильные и слабые электролиты
- •Электрическая проводимость
- •2.1 Удельная электрическая проводимость
- •2.2 Молярная и эквивалентная электрические проводимости
- •3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •Электродные процессы
- •Классификация электродов
- •Типы гальванических элементов
- •Диффузионный потенциал
- •Потенциометрическое титрование
- •Электролиз
- •Кинетика
- •Скорость химической реакции
- •Кинетическая классификация химических реакций
- •Молекулярность реакции
- •Порядок реакции
- •Реакции первого порядка
- •Реакции второго порядка
- •Влияние температуры на скорость реакции. Энергия активации
- •Методы определения порядка реакции
- •Метод подстановки
- •Графический метод
- •Метод начальных скоростей
- •Метод избытка (метод Вант - Гоффа)
- •5 Метод нахождения общего порядка реакции
- •Метод по доле непревращенного вещества к моменту времени t
Электрохимия электрическая проводимость растворов электролитов
1 Сильные и слабые электролиты
Электролитами называются такие вещества, в которых перенос электричества в электрическом поле осуществляется с помощью заряженных частиц - ионов.
Различают проводники первого и второго рода. В проводниках первого рода перенос заряда осуществляется либо при помощи электронов, либо при помощи электронов и дырок. К таким проводникам относятся металлы и полупроводники. В проводниках второго рада электрическая проводимость обуславливается положительными и отрицательными ионами. Это – растворы солей, кислот, щелочей, солевые расплавы, некоторые кристаллы солей.
Процесс распада растворенного вещества на ионы называют электролитической диссоциацией. Распад на ионы происходит независимо от того, подвергается или не подвергается вещество действию электрического тока. Образование растворов электролитов происходит по двум основным механизмам:
1 Взаимодействие ионов кристалла с диполями растворителя, приводящее к разрушению кристаллической решетки и появлению в растворе сольватированных ионов;
2 Взаимодействие с растворителем вещества, состоящего из нейтральных молекул. Так, при растворении в воде газообразного хлористого водорода получается раствор сильного электролита:
HCl + H2O → H3O+ + Cl-
Образовавшиеся ионы H3O+ и Cl- вступают во взаимодействие с молекулами растворителя, образуя сольватированные ионы.
Электролиты подразделяются на сильные и слабые. К сильным относят вещества, полностью распадающиеся на ионы при растворении. Обычно это соединения, решетка которых построена из ионов (NaCl, CaCl2, CuSo4 и другие). Слабые электролиты распадаются на ионы лишь частично, например, водные растворы аммиака, многих органических кислот. Доля распавшихся молекул на ионы называется степенью диссоциации (α).
Электролитическая диссоциация слабых электролитов носит динамический характер, в растворе непрерывно происходят процессы диссоциации электролита на ионы и соединение ионов в молекулы. К процессу электролитической диссоциации слабых электролитов применим закон действия масс.
Так, если в результате диссоциации молекул бинарного электролита получается один катион и один анион, то константа диссоциации может быть выражена следующим образом:
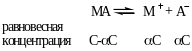
![]()
где V=1/C – разведение.
Уравнение ( ) называется законом разведения Оствальда. По теории Аррениуса константа диссоциации является постоянной для данного электролита и не зависит от концентрации. Из уравнения ( ) можно рассчитать степень диссоциации в зависимости от концентрации электролита. Решая квадратное уравнение получаем:
![]()
При малых константах диссоциации и при не очень низких концентрациях К2<<4КС из уравнения ( ) следует
![]()
Уравнения ( ) применимы только для бинарных электролитов. Для других типов электролитов математические соотношения усложняются. Константа диссоциации (а значит и степень диссоциации) зависит от температуры. Зависимость К определяется по уравнению изобары Вант-Гоффа:
![]()
где
![]() - теплота диссоциации, складывающаяся
из двух эффектов: теплоты, поглощаемой
при распаде молекул на ионы и теплоты
гидротации (сольватации) ионов молекулами
растворителя.
может быть больше и меньше нуля.
- теплота диссоциации, складывающаяся
из двух эффектов: теплоты, поглощаемой
при распаде молекул на ионы и теплоты
гидротации (сольватации) ионов молекулами
растворителя.
может быть больше и меньше нуля.
Из уравнения ( )
следует, что Кдисс
может как
расти (при
![]() >
0), так и убывать (при
< 0) с ростом температуры.
>
0), так и убывать (при
< 0) с ростом температуры.
