- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •Теплоемкость газов
- •Теплоемкость твердых тел
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •Закон Гесса
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •Анализ уравнения (1.5):
- •1.1.8 Примеры решения задач
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •Характеристика энтропии
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определение константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ.
- •1.3.7 Примеры решения задач
- •Решение
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •Однокомпонентные системы
- •Равновесие между конденсированными и газообразными фазами
- •Примеры решения задач.
- •Двухкомпонентные системы
- •2.4.1 Термический анализ как часть физико-химического анализа
- •2.4.2 Равновесие раствор – кристаллический компонент
- •2.4.3 Кривые охлаждения
- •2.4.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.4.5 Определение состава фаз и относительного количества фаз
- •2.4.6 Диаграмма состояния системы с устойчивым химическим соединением
- •2.4.7 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.4.8 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.5 Твердые растворы
- •2.5.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.5.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •2. Диаграмма с перитектическим превращением
- •2.5.3 Примеры разбора диаграмм
- •План разбора диаграммы двухкомпонентной системы
- •3Растворы
- •3.1 Теоретические понятия
- •Способы выражения состава раствора
- •3.2 Закон Рауля. Идеальные растворы
- •3.3 Следствия из закона Рауля
- •3.3.1 Повышение температуры кипения идеального раствора
- •3.3.2 Понижение температуры замерзания раствора
- •3.4 Реальные растворы
- •3.4.1 Отклонения от закона Рауля
- •3.4.2 Активность. Коэффициент активности
- •Общее давление и состав пара и жидкости. Законы Коновалова
- •3.6 Разделение бинарных смесей путем перегонки
- •3.7 Равновесие «жидкость - пар» для практически несмешивающихся жидкостей
- •3.8 Осмотическое давление
- •3.8 Закон распределения Нернста. Экстракция
- •3.9 Примеры решения задач
- •Электрохимия электрическая проводимость растворов электролитов
- •1 Сильные и слабые электролиты
- •Электрическая проводимость
- •2.1 Удельная электрическая проводимость
- •2.2 Молярная и эквивалентная электрические проводимости
- •3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •Электродные процессы
- •Классификация электродов
- •Типы гальванических элементов
- •Диффузионный потенциал
- •Потенциометрическое титрование
- •Электролиз
- •Кинетика
- •Скорость химической реакции
- •Кинетическая классификация химических реакций
- •Молекулярность реакции
- •Порядок реакции
- •Реакции первого порядка
- •Реакции второго порядка
- •Влияние температуры на скорость реакции. Энергия активации
- •Методы определения порядка реакции
- •Метод подстановки
- •Графический метод
- •Метод начальных скоростей
- •Метод избытка (метод Вант - Гоффа)
- •5 Метод нахождения общего порядка реакции
- •Метод по доле непревращенного вещества к моменту времени t
3.6 Разделение бинарных смесей путем перегонки
Различие в составе жидкой смеси и ее насыщенного пара позволяет разделить эти смеси перегонкой. Рассмотрим принципиальную схему разделения смеси состава а (рис. 10).
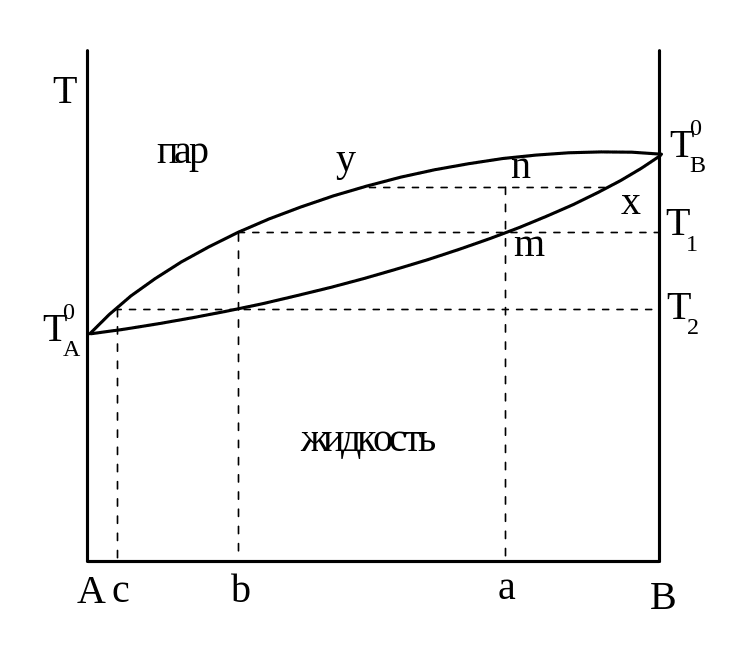
Рис. 10 Зависимость состава жидкости и пара от температуры
Смесь закипает
при температуре Т1,
и дает насыщенный пар состава b,
обогащенный
по сравнению с исходной жидкостью
компонентом А. Если сконденсировать
полученный насыщенный пар, то получим
жидкость состава b.
Эта жидкость кипит при температуре Т2
и дает насыщенный пар состава с, еще
более обогащенный компонентом А. Повторяя
эти операции, можно получить компоненты
смеси в индивидуальном состоянии, из
паровой
фазы компонент А, а компонент В из
исходной смеси, состав которой при
кипении обогащается менее летучим
компонентом, достигая в конце концов
состава В (линия m![]() ).
).
В технике различают несколько типов перегонки: перегонка в равновесии, простая перегонка и ректификационная. Перегонка в равновесии характеризуется тем, что весь пар находится в равновесии с жидкостью. Если обратиться к рис.10, то в точке т при Т1, (начало кипения) пара состава в очень мало. Поэтому нагревают систему до более высокой температуры, например, до точки п. Здесь в равновесии находятся пар у и жидкость х. Количество пара определяется отрезком пх, количество жидкости пу. Полученный пар отделяют от жидкости и конденсируют. Очевидно, что этот метод не дает полного разделения смесей, а лишь обогащает конденсат одним из компонентов.
При простой перегонке образующийся пар непрерывно удаляется и конденсируется. Состав исходной жидкости в перегонном кубе при этом непрерывно меняется. Если получаемый пар конденсировать в определенных интервалах температур, то получатся простая фракционная перегонка (рис. 11).
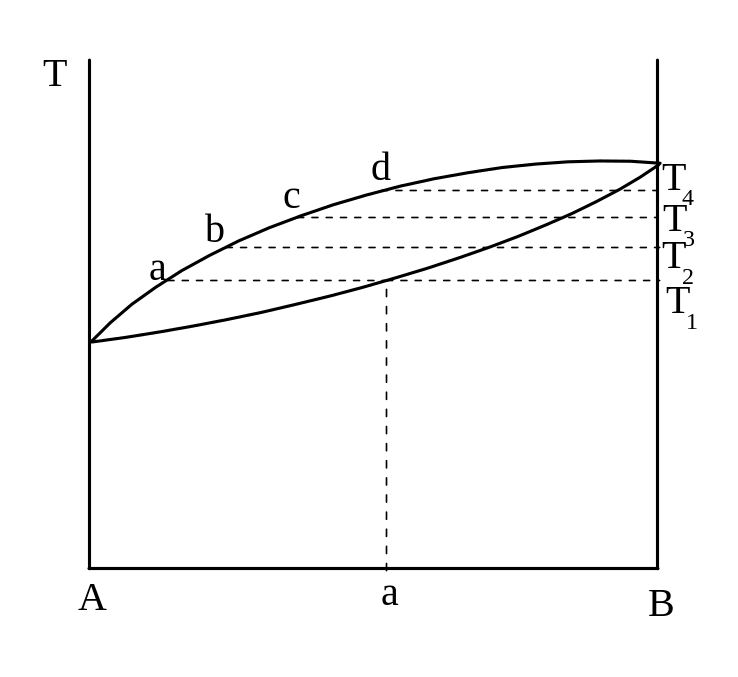
Рисунок 11 - Схема фракционной перегонки.
Так, если отводить пар в интервале температур кипения от Т1 до Т2, то получим первую фракцию конденсата, состав которой является усредненным по отношению к предельным значениям аив. При конденсации пара в других интервалах температур получают фракции другого состава.
Наиболее совершенным процессом разделения является ректификация, объединяющая последовательный ряд перегонок в равновесии в один автоматизированный процесс. Аппарат состоит из куба с исходной смесью и колонки с рядом "тарелок". Жидкость состава х1 (рисунок 12) закипает при Т1 и образующийся пар состава y1 поднимается на нижнюю тарелку, где находится конденсат, содержащий несколько больше летучего компонента, чем исходная смесь (так называемая флегма).
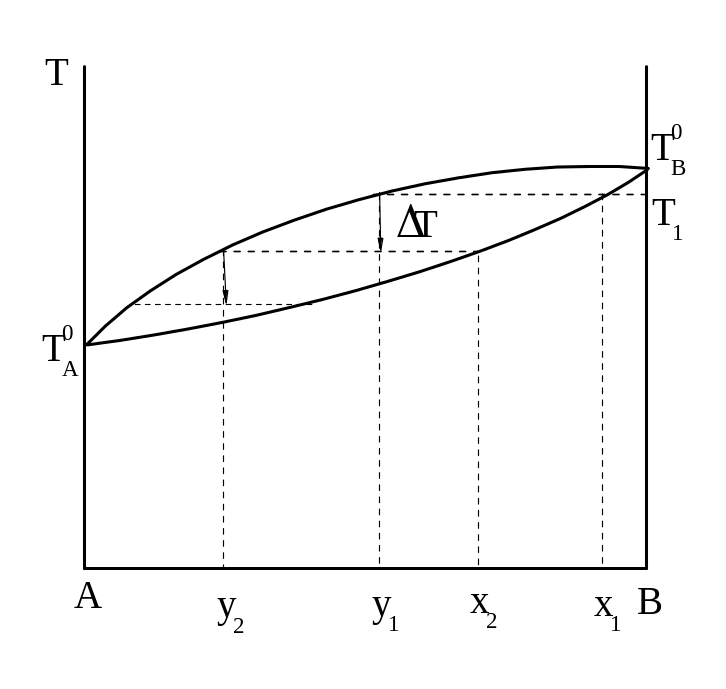
Рисунок 12 - Изменение состава пара при ректификации.
Пар, барботируя
через флегму, заставляет ее кипеть, а
сам частично охлаждается на T.
При этом он частично конденсируется
в жидкость состава х2,
а новый пар состава у2
поднимается на следующую
тарелку, где процесс повторяется. По
мере поднятия пара в колонке он все
более и более обогащается летучим
компонентом, и на выходе из колонки
получается чистый компонент А, если
число тарелок достаточно велико. Жидкость
на тарелках при их переполнении стекает
вниз и обогащается компонентом В (менее
летучим), ее температура кипения
постепенно повышается от Т1
до
![]() , а состав изменяется от Х1
до В.
, а состав изменяется от Х1
до В.
При ректификации растворов с азеотропами в чистом виде может быть получен только один из компонентов и азеотроп, который ведет себя как чистая жидкость, высоко- или низкокипящая.
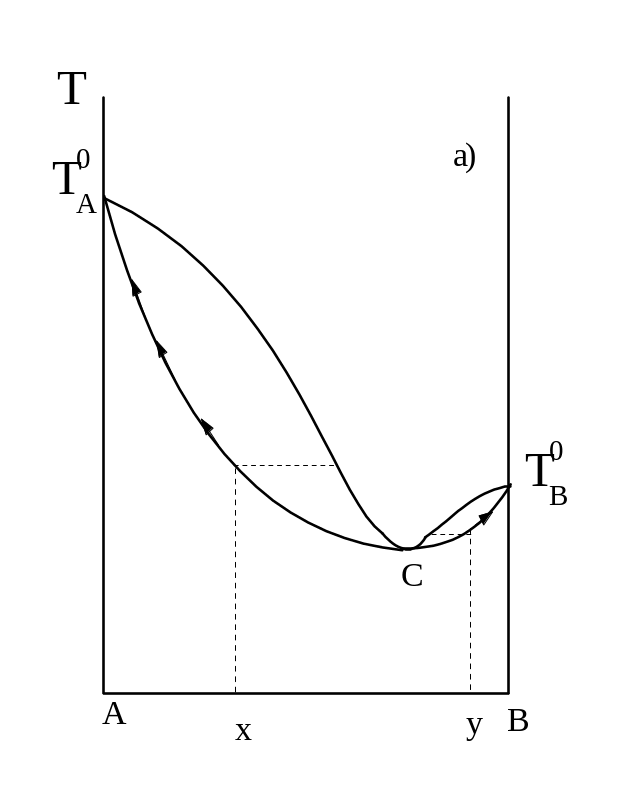
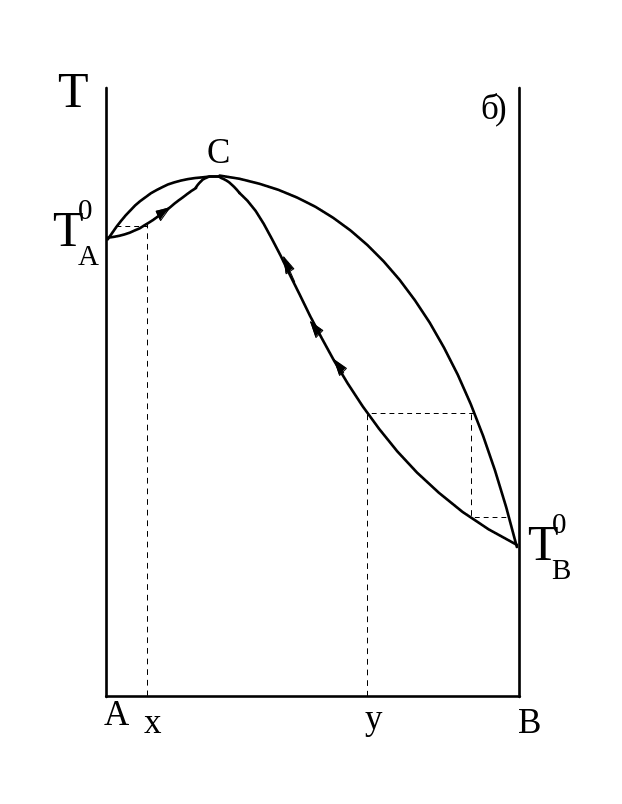
Так, в системах с минимумом на кривой Т =f(X) (рис.13) азеотроп переходит в дистиллят, а в кубе остается чистый компонент А (в случае X) и компонент В (в случае У). В системах с максимумом (рис. 13 6) отгоняется чистый компонент А (случай X) или компонент В (случай У), а в кубе остается азеотроп как более высококипящая жидкость.
|
|
Рисунок 13 – Разделение азеотропных смесей.