
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •Теплоемкость газов
- •Теплоемкость твердых тел
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •Закон Гесса
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •Анализ уравнения (1.5):
- •1.1.8 Примеры решения задач
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •Характеристика энтропии
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определение константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ.
- •1.3.7 Примеры решения задач
- •Решение
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •Однокомпонентные системы
- •Равновесие между конденсированными и газообразными фазами
- •Примеры решения задач.
- •Двухкомпонентные системы
- •2.4.1 Термический анализ как часть физико-химического анализа
- •2.4.2 Равновесие раствор – кристаллический компонент
- •2.4.3 Кривые охлаждения
- •2.4.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.4.5 Определение состава фаз и относительного количества фаз
- •2.4.6 Диаграмма состояния системы с устойчивым химическим соединением
- •2.4.7 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.4.8 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.5 Твердые растворы
- •2.5.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.5.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •2. Диаграмма с перитектическим превращением
- •2.5.3 Примеры разбора диаграмм
- •План разбора диаграммы двухкомпонентной системы
- •3Растворы
- •3.1 Теоретические понятия
- •Способы выражения состава раствора
- •3.2 Закон Рауля. Идеальные растворы
- •3.3 Следствия из закона Рауля
- •3.3.1 Повышение температуры кипения идеального раствора
- •3.3.2 Понижение температуры замерзания раствора
- •3.4 Реальные растворы
- •3.4.1 Отклонения от закона Рауля
- •3.4.2 Активность. Коэффициент активности
- •Общее давление и состав пара и жидкости. Законы Коновалова
- •3.6 Разделение бинарных смесей путем перегонки
- •3.7 Равновесие «жидкость - пар» для практически несмешивающихся жидкостей
- •3.8 Осмотическое давление
- •3.8 Закон распределения Нернста. Экстракция
- •3.9 Примеры решения задач
- •Электрохимия электрическая проводимость растворов электролитов
- •1 Сильные и слабые электролиты
- •Электрическая проводимость
- •2.1 Удельная электрическая проводимость
- •2.2 Молярная и эквивалентная электрические проводимости
- •3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •Электродные процессы
- •Классификация электродов
- •Типы гальванических элементов
- •Диффузионный потенциал
- •Потенциометрическое титрование
- •Электролиз
- •Кинетика
- •Скорость химической реакции
- •Кинетическая классификация химических реакций
- •Молекулярность реакции
- •Порядок реакции
- •Реакции первого порядка
- •Реакции второго порядка
- •Влияние температуры на скорость реакции. Энергия активации
- •Методы определения порядка реакции
- •Метод подстановки
- •Графический метод
- •Метод начальных скоростей
- •Метод избытка (метод Вант - Гоффа)
- •5 Метод нахождения общего порядка реакции
- •Метод по доле непревращенного вещества к моменту времени t
Равновесие между конденсированными и газообразными фазами
Это равновесие типа кристаллы пар; жидкость пар. Для этих фазовых равновесий всегда положительны, так как ΔН > 0 и ΔV > 0. Это значит, что нагревание системы всегда вызовет увеличение давления насыщенного пара, а повышение внешнего давления приведет к повышению температуры кипения (линии ОВ и ОС на рисунке 2.1).
Приведем уравнение 2.1 к виду более удобному для практического применения. Используем два приближения:
1. При температурах, далеких от критической, Vпар>>Vж; Vпар>>Vтв.; ΔV ≈ Vпар.
2. Вдали от критической температуры насыщенный пар подчиняется уравнению состояния идеальных газов
![]() ,
,
Тогда уравнение (2.1) преобразуется следующим образом:
![]() ,
или
,
или
![]() (2.4)
(2.4)
Интегрирование
этого уравнения при
![]() дает линейную зависимость lnP
от
дает линейную зависимость lnP
от
![]()
![]()
![]() (2.5)
(2.5)
![]()
![]()
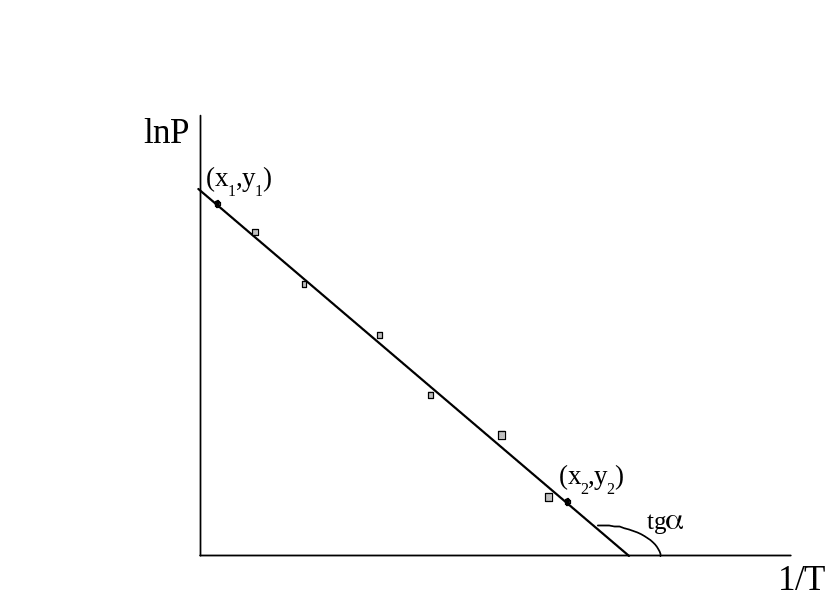
Рисунок 2.2 – зависимость давления насыщенного пара от температуры в координатах (ln P;1/Т)
![]() - тангенс угла
наклона прямой к оси абцисс:
- тангенс угла
наклона прямой к оси абцисс:
![]() ,
,
где (y2; х2), (y1; х1) – координаты двух точек, лежащих на прямой.
Точки (не обязательно экспериментальные) выбирать отстоящими подальше друг от друга.
Коэффициент «b» из графика найти невозможно, если в начале координат не 0. Поэтому найти «b» можно из уравнения для какой-либо точки, лежащей на прямой. Определив «а», найти теплоту испарения:
ΔН = - Rtgα,
где R=8,31 Дж/моль·К.
Интегрирование уравнения в определенных пределах приводит к уравнению:
![]() (2.6)
(2.6)
по которому можно рассчитать теплоту испарения по двум экспериментальным значениям давлений и температур.
Согласно эмпирическому правилу Трутона молярная энтропия испарения при нормальной температуре кипения для многих жидкостей постоянна и равна:
![]()
где Тн.т.к. – нормальная температура кипения при Р = 1 атм.
Для полярных
жидкостей с сильными межмолекулярными
взаимодействиями ΔSисп.
превышает данную величину. Например,
для воды она равна 109
![]() .
.
Примеры решения задач.
Задача 1
Зависимость температуры плавления нафталина от давления выражается уравнением: tпл = 80,10 + 0,037110-5P(Па) – 186,9910-18Р2 (Па).
Рассчитать изменение объема при плавлении 1 кг нафталина при Р = 1 атм, если его теплота плавления равна 138,6 Дж/кг.
Дано:
mнафт. = 1 кг
Нпл. = 138,6 Дж/г
Р = 1 атм = 1,0133105 Па
Vпл. - ?
Решение:
![]()
Для фазовых
переходов конденсированных фаз
применяется уравнение:
![]() .
.
Определим сначала
производную
![]() .
Так как Т = t
+ 273,15;
.
Так как Т = t
+ 273,15;
![]() ;
;
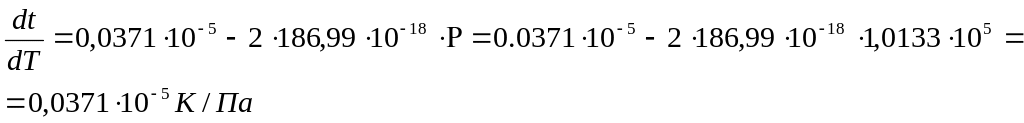
Откуда
![]()
![]()
![]()
![]()
Задача 2
Давление пара хлороформа при 50 0С равно 535 мм. рт. ст., теплота испарения хлороформа 30,836 кДж/моль. Определить нормальную температуру кипения хлороформа.
Дано:
T1=50 0C = 323 К
Р1 = 535 мм. рт. ст.
Р2 = 1 атм. = 760 мм.рт.ст.
Нисп. = 30,836 кДж/моль
Т2 кип. - ?
Решение:
Нормальная температура кипения (н.т.к.) – температура кипения при Р = 1 атм.
![]()
Для решения используется уравнение для фазового перехода с участием газов:
![]()
![]()
![]()
Т2 = 333 К
Примечание. В данной задаче теплота испарения в данном температурном интервале принята постоянной, поэтому было использовано уравнение для Н = соnst.
Если же Нисп. = f (Т), то надо использовать дифференциальное уравнение для нахождения Нисп или Нвозг. Поскольку зависимости lnP=f(T) и lnKP=f(T) аналогичны, предлагаем обратиться к решению задачи № 3 на странице 42.
