
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •Теплоемкость газов
- •Теплоемкость твердых тел
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •Закон Гесса
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •Анализ уравнения (1.5):
- •1.1.8 Примеры решения задач
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •Характеристика энтропии
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определение константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ.
- •1.3.7 Примеры решения задач
- •Решение
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •Однокомпонентные системы
- •Равновесие между конденсированными и газообразными фазами
- •Примеры решения задач.
- •Двухкомпонентные системы
- •2.4.1 Термический анализ как часть физико-химического анализа
- •2.4.2 Равновесие раствор – кристаллический компонент
- •2.4.3 Кривые охлаждения
- •2.4.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.4.5 Определение состава фаз и относительного количества фаз
- •2.4.6 Диаграмма состояния системы с устойчивым химическим соединением
- •2.4.7 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.4.8 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.5 Твердые растворы
- •2.5.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.5.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •2. Диаграмма с перитектическим превращением
- •2.5.3 Примеры разбора диаграмм
- •План разбора диаграммы двухкомпонентной системы
- •3Растворы
- •3.1 Теоретические понятия
- •Способы выражения состава раствора
- •3.2 Закон Рауля. Идеальные растворы
- •3.3 Следствия из закона Рауля
- •3.3.1 Повышение температуры кипения идеального раствора
- •3.3.2 Понижение температуры замерзания раствора
- •3.4 Реальные растворы
- •3.4.1 Отклонения от закона Рауля
- •3.4.2 Активность. Коэффициент активности
- •Общее давление и состав пара и жидкости. Законы Коновалова
- •3.6 Разделение бинарных смесей путем перегонки
- •3.7 Равновесие «жидкость - пар» для практически несмешивающихся жидкостей
- •3.8 Осмотическое давление
- •3.8 Закон распределения Нернста. Экстракция
- •3.9 Примеры решения задач
- •Электрохимия электрическая проводимость растворов электролитов
- •1 Сильные и слабые электролиты
- •Электрическая проводимость
- •2.1 Удельная электрическая проводимость
- •2.2 Молярная и эквивалентная электрические проводимости
- •3.3 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •Электродные процессы
- •Классификация электродов
- •Типы гальванических элементов
- •Диффузионный потенциал
- •Потенциометрическое титрование
- •Электролиз
- •Кинетика
- •Скорость химической реакции
- •Кинетическая классификация химических реакций
- •Молекулярность реакции
- •Порядок реакции
- •Реакции первого порядка
- •Реакции второго порядка
- •Влияние температуры на скорость реакции. Энергия активации
- •Методы определения порядка реакции
- •Метод подстановки
- •Графический метод
- •Метод начальных скоростей
- •Метод избытка (метод Вант - Гоффа)
- •5 Метод нахождения общего порядка реакции
- •Метод по доле непревращенного вещества к моменту времени t
1.2.7 Химический потенциал идеального и реального газа
Основным признаком химической реакции и многих процессов в растворах является изменение состава системы. Поэтому общее изменение энергии системы при различных процессах зависит не только от термодинамических параметров (P, V, T, S и т.д.), но и от количества вещества, участвующего в процессе. Рассмотрим на примере энергии Гиббса.
Так, G = f (P, T, n1, n2, n3 …..)
При Р, Т = сonst
G = f (n1, n2, n3)
Полное изменение энергии Гиббса:
![]()
Величина
![]() - называется химическим потенциалом.
- называется химическим потенциалом.
Химический
потенциал i
– го компонента
– это изменение энергии Гиббса всей
системы при бесконечно малом изменении
количества данного газа (в расчете на
1 моль), при постоянных Р и Т и при
неизменных количествах прочих газов
(знак
![]() - «кроме ni»).
- «кроме ni»).
Химический
потенциал индивидуального газа,
![]() ,
равен энергии Гиббса одного моля этого
газа,
,
равен энергии Гиббса одного моля этого
газа,
![]() при
постоянных Р и Т. Химический потенциал
может быть выражен и через энергию
Гельмгольца:
при
постоянных Р и Т. Химический потенциал
может быть выражен и через энергию
Гельмгольца:
![]()
При Т = const химический потенциал зависит от давления.
![]() - для индивидуального
газа.
- для индивидуального
газа.
![]() - для газа в смеси,
- для газа в смеси,
где
![]() - стандартные химические потенциалы
(при Рi
= 1)
- стандартные химические потенциалы
(при Рi
= 1)
Следует отметить,
что величина Р под логарифмом является
относительной, то есть отнесенной к
стандартному давлению
![]() ,
следовательно – безразмерной.
,
следовательно – безразмерной.
Если давление выражено в атмосферах, то относится к 1 атм. , если в Паскалях – к 1,0133105 Па; если в мм.рт.ст. – к 760 мм.рт.ст. В случае реального газа вместо давления подставляем относительную фугитивность:
![]() - для индивидуального
газа
- для индивидуального
газа
![]() - для газа в смеси
- для газа в смеси
1.2.8 Примеры решения задач
Задача 1.
Рассчитать изменение энтропии при смешении 200 м3 азота при 700 К и 500 м3 гелия при Т = 300 К при Р = I атм.
Дано:
V(N2) = 200 м3 ; V(He) = 500 м3 ;
Т (N2) = 700 К; Т (He) = 300 К
Р = 1 атм
S = ?
Решение: Расчет S смешения производится по уравнению
S
=
- R![]() .
.
Это уравнение можно использовать, если давление и температура обоих газов одинаковы. В данном случае давления равны, а температура при смешении газов будет выравниваться, поэтому необходимо найти температуру смеси Тх. При смешении температура азота уменьшается, то есть азот передает какое-то количество теплоты гелию, а гелий принимает эту теплоту и повышает свою температуру. По абсолютной величине количество теплоты одно и то же, но знаки разные, поэтому, чтобы составить уравнение теплового баланса, следует одну из теплот взять с обратным знаком, то есть Q (N2) = - Q (Не)
Примем Ср = const и рассчитаем по классической теории. Молярная теплоемкость для двухатомных газов Ср = 7/2 R , для одноатомных Ср = 5/2 R, Дж/моль·К; R = 8,31 Дж/моль·К;
![]() Дж/К
Дж/К
![]() Дж/К
Дж/К
![]() 20,3•103
моль
20,3•103
моль
![]() моль
моль
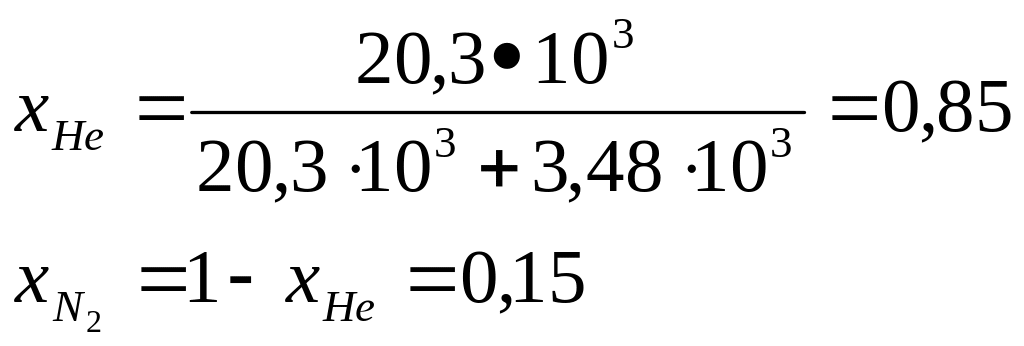
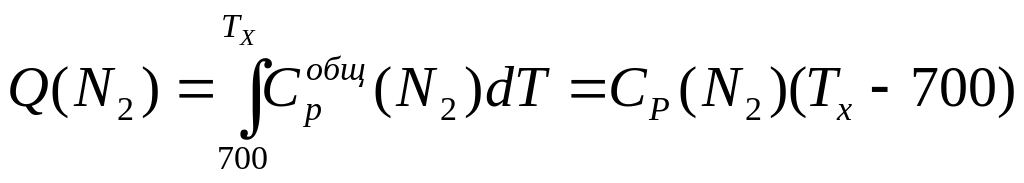
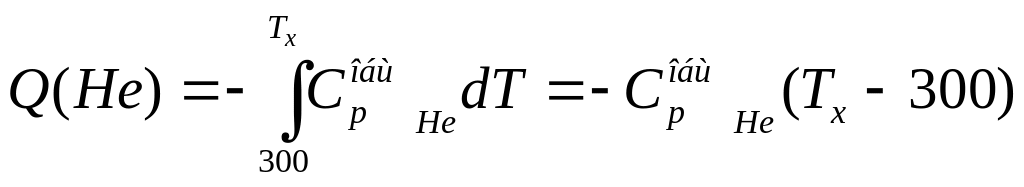
101.103(Tx-700) = -422•103(Tx-300)
Tx= 377 К
При выравнивании температур произошло изменение энтропии азота и гелия
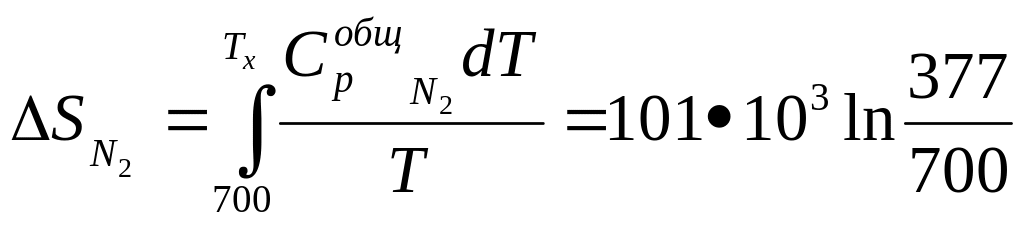 =
-62,5•.103
Дж/К
=
-62,5•.103
Дж/К
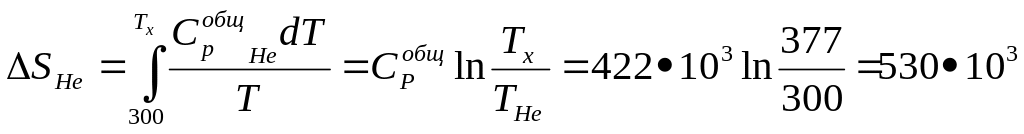 Дж/К
Дж/К
Теперь рассчитываем изменение энтропии при смешении
![]()
Общее изменение энтропии системы равно сумме изменений энтропии всех стадий процесса
S = -62,5• 103 +530•103 + 82,3•103 = 549•103 Дж/К
Задача 2.
Рассчитать S реакции 2 S02 + 02 = 2 S03 при стандартных условиях. Можно ли сделать вывод о возможности окисления S02 кислородом в этих условиях?
Решение:
![]()
Значения
абсолютных энтропии берем из справочника
![]() Дж/моль.К;
Дж/моль.К;
![]() Дж/моль.К;
Дж/моль.К;
![]() =205,04 Дж/моль.К
=205,04 Дж/моль.К
![]() .
= - 187,8
Дж/К
.
= - 187,8
Дж/К
Полученное значение нельзя использовать для определения возможности процесса, так как реакция идет при стандартных условиях, то есть при Р и Т = const, а не в изолированной системе.
При Р и Т = const
следует рассчитать значение
![]() .
.
![]() =
=![]()
Поскольку изменение энергии Гиббса меньше нуля, следовательно, реакция в прямом направлении пойдет.
