
- •Феноменологическая кинетика
- •Различия между химической термодинамикой и кинетикой:
- •I.1. Основные понятия и определения
- •Измерение скорости реакции.
- •I.2. Кинетика односторонних реакций различных порядков.
- •I.3. Методы определения порядка реакций.
- •I.4. Влияние температуры на скорость реакций
- •II. Сложные реакции
- •II.1. Обратимые реакции
- •II.2. Параллельные реакции
- •II.3. Последовательные реакции
- •II.4. Приближенные методы химической кинетики Квазистационарное приближение
- •Квазиравновесное приближение
- •II.5. Цепные реакции
- •Неразветвленные цепные реакции
- •Разветвленные цепные реакции
- •II.6. Фотохимические реакции
- •Законы фотохимии
- •Основные типы фотохимических процессов
- •III.Теории химической кинетики
- •Теория активных столкновений (тас)
- •Теория активного комплекса (так)
- •IV. Катализ
- •IV.1. Основные понятия и определения
- •IV.2. Гомогенный катализ
- •Ферментативный катализ
- •Определение кинетических параметров уравнения Михаэлиса-Ментен.
- •Ингибирование
- •IV.3. Гетерогенный катализ
- •Вопросы для самоконтроля Кинетика
- •Тема 1. Основные понятия и постулаты химической кинетики. Кинетика химических реакций в статических и динамических условиях.
- •Тема 2. Основы кинетики отдельных типов химических реакций
- •Тема 3. Теории химической кинетики
- •Тема 4. Катализ
- •Содержание
- •I. Феноменологическая кинетика………………………….….….4
II.2. Параллельные реакции
Параллельные реакции – реакции, в которых исходные вещества одновременно превращаются по нескольким направлениям с образованием различных продуктов. Например: при нитровании, сульфировании, галоидировании ароматических органических соединениймогут получаться орто-, мета- и паразамещенные; при крекинге нефти – газообразные углеводороды, при взаимодействии СО и Н2 – углеводороды, спирты, альдегиды и т.д. Схема параллельной реакции первого порядка:
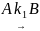 и
и
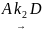
Для скоростей такой реакции можно записать (с учетом принципа независимости):
υ1=k1CA, и υ2= k2CA.
Тогда:
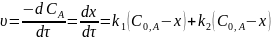
или
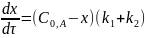
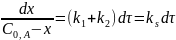
Интегральные формы кинетического уравнения реакции 1-го порядка:
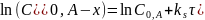

Текущая концентрация исходного вещества:
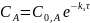
Общая концентрация продуктов реакции:
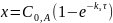
Для скорости образования продуктов реакции, с учетом их отсутствия в начальный момент, можно записать:

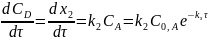
После дифференцирования:

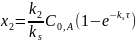
Отношение концентраций продуктов постоянно, не зависит от времени и определяется отношением констант скоростей реакций:
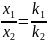
Зная константу ks и концентрации продуктов реакции в момент времени τ можно найти константы скоростей для каждой реакции. Зависимости концентраций веществ от времени для параллельной реакции первого порядка представлены на рисунке 6.
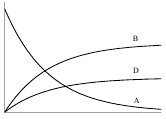
Рис. 6. Зависимость концентраций веществ А, В, D от времени для параллельной реакции первого порядка (k1˃k2).
II.3. Последовательные реакции
Последовательные реакции – такие реакции, в которых образующиеся на первой стадии вещества являются реагентами в последующих стадиях. Каждая из реакций может быть моно-, би- или тримолекулярной, односторонней или двусторонней, любого порядка. Пример: гидролиз эфиров двухосновных кислот, гидрирование фенола до циклогексанола и др.
Схема односторонней последовательной реакции первого порядка:

Для скоростей такой реакции можно записать:
υ1=k1CA, и υ2= k2CВ.
Тогда дифференциальные формы кинетических уравнений с учетом отсутствия веществ B и D в начальный момент времени имеют вид:
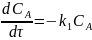 или
или
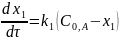
 или
или

 или
или

Интегральные формы кинетических уравнений:
или
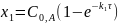
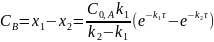
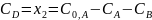 или
или
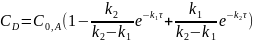
Из уравнений следует:
Концентрация исходного вещества монотонно уменьшается с течением времени по экспоненциальному закону (при τ СA 0).
Концентрация конечного продукта в пределе стремится к исходной концентрации вещества А (при τ СD C0,A), т.е. исходное вещество полностью превращается в продукт.
Концентрация промежуточного продукта проходит через максимум, так как при τ = 0 СB = 0 и при τ СB 0, а в любой другой момент времени концентрация СB >0.
Зависимости концентрации веществ от времени для последовательной реакции первого порядка представлены на рисунке 7.
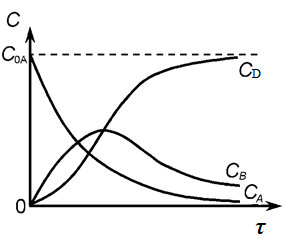
Рис. 7. Зависимость концентраций веществ А, В, D от времени для последовательной реакции первого порядка.
Время достижения максимума τмакс промежуточного вещества можно определить из условия экстремума (приравняем первую производную нулю):
 .
.
Продифференцируем уравнение:

и получим
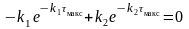 .
.
После логарифмирования и решения этого уравнения относительно τ получим:

и соответствует концентрации:
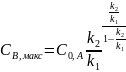
т.е. время достижения максимума зависит от соотношения констант скоростей k2 и k1 , но и от их абсолютных значений.
