
- •Феноменологическая кинетика
- •Различия между химической термодинамикой и кинетикой:
- •I.1. Основные понятия и определения
- •Измерение скорости реакции.
- •I.2. Кинетика односторонних реакций различных порядков.
- •I.3. Методы определения порядка реакций.
- •I.4. Влияние температуры на скорость реакций
- •II. Сложные реакции
- •II.1. Обратимые реакции
- •II.2. Параллельные реакции
- •II.3. Последовательные реакции
- •II.4. Приближенные методы химической кинетики Квазистационарное приближение
- •Квазиравновесное приближение
- •II.5. Цепные реакции
- •Неразветвленные цепные реакции
- •Разветвленные цепные реакции
- •II.6. Фотохимические реакции
- •Законы фотохимии
- •Основные типы фотохимических процессов
- •III.Теории химической кинетики
- •Теория активных столкновений (тас)
- •Теория активного комплекса (так)
- •IV. Катализ
- •IV.1. Основные понятия и определения
- •IV.2. Гомогенный катализ
- •Ферментативный катализ
- •Определение кинетических параметров уравнения Михаэлиса-Ментен.
- •Ингибирование
- •IV.3. Гетерогенный катализ
- •Вопросы для самоконтроля Кинетика
- •Тема 1. Основные понятия и постулаты химической кинетики. Кинетика химических реакций в статических и динамических условиях.
- •Тема 2. Основы кинетики отдельных типов химических реакций
- •Тема 3. Теории химической кинетики
- •Тема 4. Катализ
- •Содержание
- •I. Феноменологическая кинетика………………………….….….4
II. Сложные реакции
Сложные реакции состоят из нескольких стадий, связанных между собой. Изучение сложных реакций проводят с использованием основного постулата химической кинетики, а также принципов: независимости, лимитирующей стадии и детального равновесия.
Принцип независимости протекания реакций. Число элементарных актов химического превращения по сравнению с числом столкновений молекул в единице объема невелико, а совершаются они за относительно короткий отрезок времени (~10-11с). Поэтому можно считать, что каждый из них протекает независимо друг от друга. Отсюда следует, если в системе имеет место несколько элементарных реакций (стадий), то каждая из них протекает по тем же законам, с той же скоростью, как и в отсутствии других реакций при тех же концентрациях и температуре. В этом состоит принцип независимости протекания реакций. Это положение справедливо для реакций, протекающих как в закрытых, так и в открытых системах. Из принципа независимости вытекает важное следствие. Если в системе протекает несколько элементарных реакций или стадий одной сложной реакции с участием одного и того же вещества, то изменение концентрации последнего будет равно алгебраической сумме скоростей каждой стадии, умноженных на стехиометрический коэффициент этого вещества в данной стадии.
Принцип лимитирующей стадии: если процесс состоит из нескольких стадий, то стадия, константа скорости которой наименьшая, является лимитирующей, т.е. определяет скорость всего процесса.
Принцип детального равновесия: если в сложной реакции устанавливается равновесие, то скорости прямой и обратной реакций должны быть равны для каждой из элементарных стадий.
Характерные признаки сложной реакции:
Несовпадение порядка реакции и стехиометрических коэффициентов.
Ускорение или замедление процесса при добавление в реакционную смесь небольших количеств веществ.
Возможное изменение состава продуктов в зависимости от условий (температуры, начальных концентраций и т.д.)
Существенное влияние на скорость процесса незначительного изменения условий эксперимента.
II.1. Обратимые реакции
Обратимые реакции – реакции, протекающие как в прямом, так и в обратном направлениях. Например, реакции изомеризации в газовой фазе или в растворе: бутан↔изобутан, α-глюкоза↔β-глюкоза и др. Схема обратимой реакции первого порядка:
k1
А ↔ В
k-1
Для скорости такой реакции можно записать:
υ=υ1- υ-1
где υ1=k1CA, υ-1= k-1CB. Тогда:

или

В
состоянии равновесия
 :
:

или

где
 – количество вещества А,
прореагировавшего до наступления
равновесия.
– количество вещества А,
прореагировавшего до наступления
равновесия.
Тогда, в дифференциальном виде скорость реакции можно представить в виде выражения:

или

Интегральные формы кинетического уравнения:

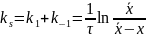

Так как, в состоянии равновесия υ1=υ-1, то:


где
 -
суммарная константа скорости; Кс
– концентрационная константа равновесия;
-
суммарная константа скорости; Кс
– концентрационная константа равновесия;
 и
и
 – равновесные концентрации веществ.
– равновесные концентрации веществ.
Константы скорости прямой и обратной реакций равны:


Зависимости концентрации веществ от времени для обратимой реакции первого порядка представлены на рисунке 5.
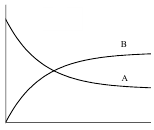
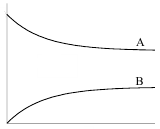
Кс>1 Кс<1
Рис. 5. Зависимость концентрации веществ А и В от времени для обратимой реакции первого порядка при Кс > 1 и Кс < 1.
