- •Феноменологическая кинетика
- •Различия между химической термодинамикой и кинетикой:
- •I.1. Основные понятия и определения
- •Измерение скорости реакции.
- •I.2. Кинетика односторонних реакций различных порядков.
- •I.3. Методы определения порядка реакций.
- •I.4. Влияние температуры на скорость реакций
- •II. Сложные реакции
- •II.1. Обратимые реакции
- •II.2. Параллельные реакции
- •II.3. Последовательные реакции
- •II.4. Приближенные методы химической кинетики Квазистационарное приближение
- •Квазиравновесное приближение
- •II.5. Цепные реакции
- •Неразветвленные цепные реакции
- •Разветвленные цепные реакции
- •II.6. Фотохимические реакции
- •Законы фотохимии
- •Основные типы фотохимических процессов
- •III.Теории химической кинетики
- •Теория активных столкновений (тас)
- •Теория активного комплекса (так)
- •IV. Катализ
- •IV.1. Основные понятия и определения
- •IV.2. Гомогенный катализ
- •Ферментативный катализ
- •Определение кинетических параметров уравнения Михаэлиса-Ментен.
- •Ингибирование
- •IV.3. Гетерогенный катализ
- •Вопросы для самоконтроля Кинетика
- •Тема 1. Основные понятия и постулаты химической кинетики. Кинетика химических реакций в статических и динамических условиях.
- •Тема 2. Основы кинетики отдельных типов химических реакций
- •Тема 3. Теории химической кинетики
- •Тема 4. Катализ
- •Содержание
- •I. Феноменологическая кинетика………………………….….….4
Законы фотохимии
Закон Гротгуса – Дрепера (I законом фотохимии): только поглощенное средой световое излучение может произвести ее химическое изменение. Однако обратное утверждение о том, что лучи, которые поглощается, являются химически активными, в общем случае является неверным, так как поглощение света не обязательно приводит к химической реакции. Это условие необходимое, но недостаточное.
Поглощение монохроматического света с длиной волны описывается объединенным законом Бугера - Ламберта – Бера: ослабление интенсивности dI света, прошедшего через слой толщиной dl, прямо пропорционально толщине слоя, интенсивности падающего света I и числу поглощающих частиц n (или их концентрации в слое):
– dI = kIdl
где коэффициент пропорциональности k – молекулярный коэффициент поглощения, который является мерой поглощательной способности молекулы для данной длины волны и в первом приближении не зависит от концентрации. После интегрирования в пределах от 0 до l (l -общая толщина поглощающего слоя) и I от Io (интенсивность падающего света) до I (интенсивность прошедшего света) получим выражение:
 .
.
Если концентрацию выражать числом молей вещества в литре раствора (c), то
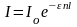 ,
,
– молярный коэффициент поглощения, связанный с k соотношением kn = c.
Отношение
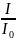 – пропускание, а выражение
– пропускание, а выражение
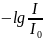 – поглощение среды или оптическая
плотность.
– поглощение среды или оптическая
плотность.
Количество световой энергии A, поглощенной в единицу времени фотохимической системой, равно:
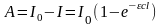 ,
,
Закон Вант-Гоффа - обобщение всех закономерностей: количество фотохимически измененного вещества пропорционально поглощенной энергии света. Количество фотохимически измененного вещества dc в единицу времени, т.е. скорость реакции, пропорциональна A:

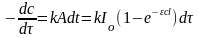 .
.
Если концентрация очень мала или поглощающий слой очень тонкий (величина cl мала), то после разложения экспоненты в ряд получим:
 ,
,
т.е. фотохимическая реакция протекает по первому порядку, ее скорость пропорциональна концентрации реагирующего вещества.
При
больших концентрациях или толстом
поглощающем слое (cl
велико,
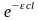 <<
1) весь световой поток поглощается:
<<
1) весь световой поток поглощается:
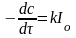 ,
,
т.е. скорость реакции постоянна и не зависит от концентрации реагирующего вещества (нулевой порядок).
Закон фотохимической эквивалентности Штарка – Эйнштейна (II закон фотохимии): каждый поглощенный квант света h в первичном акте вызывает превращение одной молекулы.
Энергия моля квантов света:
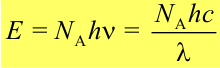
Число фотохимически прореагировавших молекул не равно числу поглощенных квантов. В связи с этим для характеристики фотохимических процессов введено понятие квантового выхода . Различают первичный, вторичный и общий квантовые выходы.
Первичный квантовый выход (всегда <1) равен отношению числа прореагировавших возбужденных молекул в первичном акте (n) к числу поглощенных квантов (A/h):
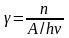
Тогда число прореагировавших молекул
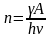
и скорость химической реакции

Это уравнение объединяет все законы фотохимии и представляет собой общее выражение для скорости фотохимической реакции.
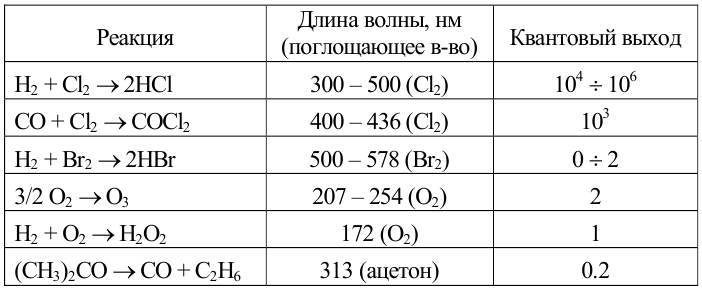
Общий квантовый выход равен отношению числа образовавшихся в процессе молекул продукта (или числа прореагировавших молекул реагента) к числу поглощенных квантов. Для реакций, протекающих в растворах < 1. При значениях » 1 рассматриваемый фотохимический процесс имеет цепной характер. Интервал возможных изменений: от 10-3 (фотохимическое разложение метилбромида) до 106 (цепная реакция водорода с хлором); в общем случае, чем более долгоживущей является активная частица, тем с большим квантовым выходом протекает фотохимическая реакция.
Вторичный квантовый выход является мерой развития вторичных реакций и равен отношению числа образовавшихся в процессе молекул продукта к числу молекул, прореагировавших в первичном акте.
Характеристики некоторых фотохимических реакций