
- •Структура и физико-химические свойства белков
- •1. Уровни структурной организации белков: первичная, вторичная, третичная и четвертичная структуры
- •0,124 Нм боковой радикал α-углеродный атом
- •1. Действуют аминопептидазой и получают n-концевую аминокислоту;
- •2. Примененяют метод Эдмана:
- •1. Гидролиз пептидной связи действием карбоксипептидазы и получение аминокислоты со свободной соон группой.
- •1.3Вторичная структура
- •1.5 Четвертичная структура –
- •2. Физико-химические свойства белков
- •2.1 Форма и размер белковых молекул
- •3 Типа белков:
- •4. Денатурация и ее значение в пищевой промышленности.
- •3. Классификация белков
- •4. Методы выделения, очистки и фракционирования белков
- •Глюкозы (г)
- •Двумерный электрофорез
- •5. Методы количественного и качественного определения белков в биологических объектах
1.3Вторичная структура
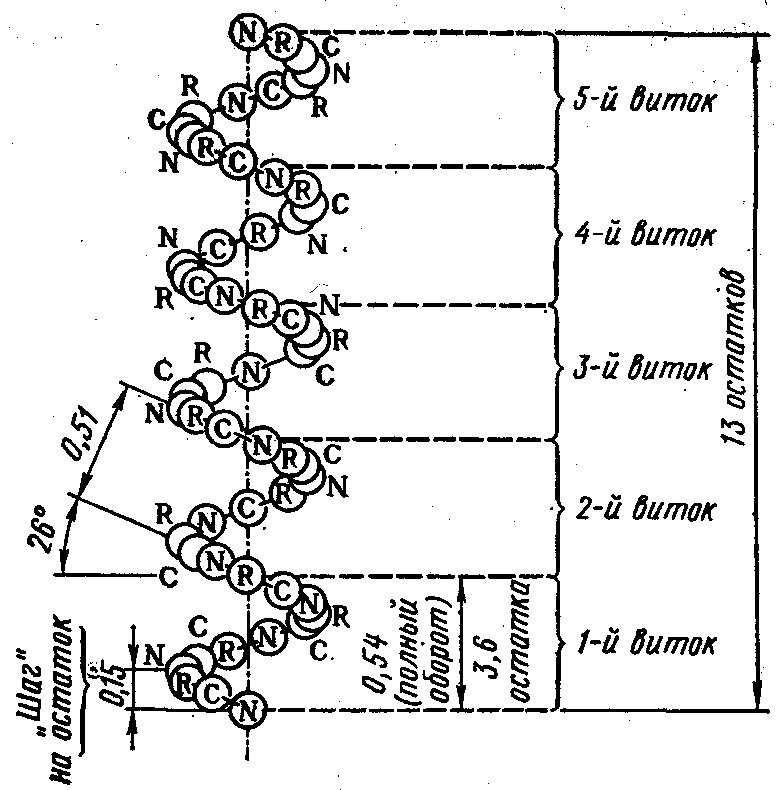
Белковая молекула не лежит в одной плоскости. Полинг и Кори показали, что многие белки имеют конфигурацию α-спирали, которую можно представить себе в виде правовращающейся спирали, идущей по поверхности воображаемого цилиндра.
|
1. Шаг спирали равен 5,4 A;
2. На каждом витке умещается 3,6 аминокислотных остатка
3. На 1 аминокислотный остаток приходится 1,5 А
4. Структура образуется за счет водородных связей |
Водородные связи слабые. Возникают между атомом Н, несущим положительный заряд и атомом кислорода пептидной группы четвертой по счету пептидной связи, обладающим отрицательным зарядом. Такие связи возникают при близком расположении в пространстве пептидных связей.

Водородные связи могут возникать между отрицательно заряженным (-) кислотным остатком и спиртом или фенолом, а так же между фенолом и имидозольным кольцом гистидина.
Энергия водородных связей мала по сравнению с энергией ковалентных связей: 1-7 ккал против 50-100 ккал на молекулу. Водородные связи выполняют 2 функции:
– обеспечивают устойчивость конфигурации
- образовывают комплекс 2-х молекул (фермент – субстрат и т. д.)
α - Структура белковой молекулы Вертикальные линии – водородные связи
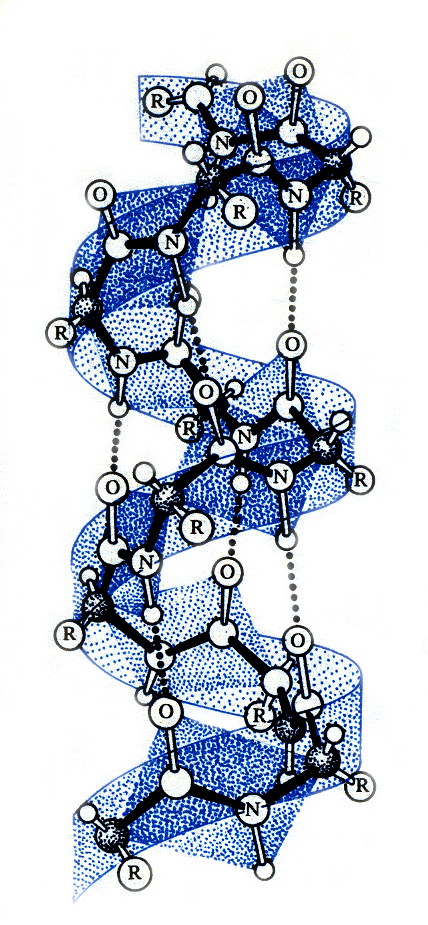
α-Спираль характерна как для глобулярных белков (миоглобин, альбумин сыворотки крови, гемоглобин, ферменты, антитела, гормоны - 50-75%), так и фибриллярных, например -кератина.
Некоторые белки обладают β-структурой (β-кератин, фиброин шёлка), представляющую как бы ряд листков, расположенных под углом друг к другу Полипептидная цепь вытянута, а боковые цепи расположены вверх или вниз от неё. Структура имеет вид складчатого слоя или плессированого листа.
При одинаковом расположении цепей, начиная с N –конца и заканчивая С-концом, образуется параллельная -структура, при разном - ( N-конец, С-конец) – -антипараллельная структура (фиброин шелка тутового шелкопряда).

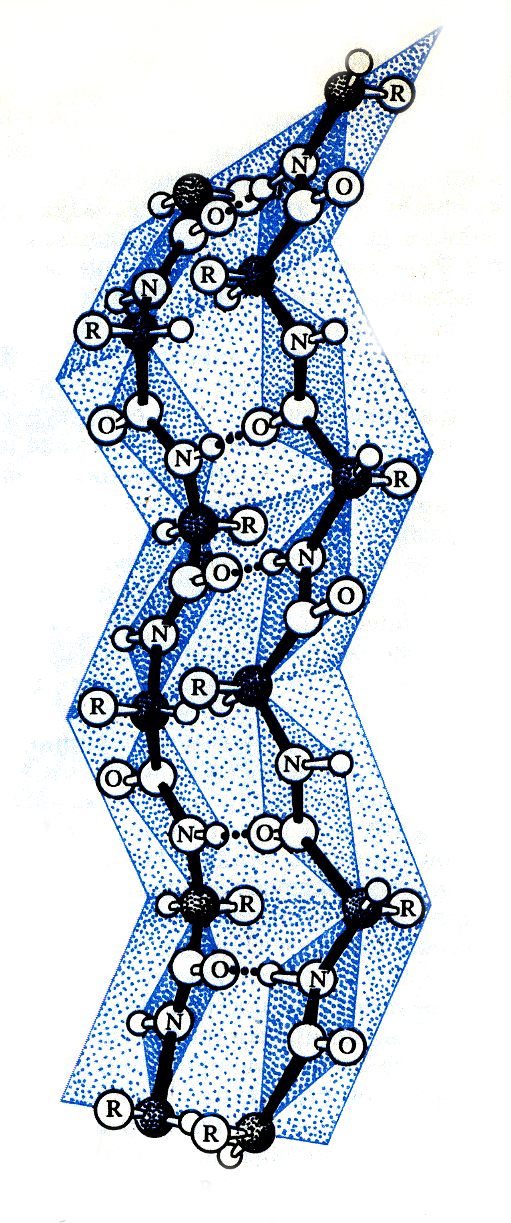
β – Складчатая структура. R – радикалы аминокислотных остатков
1.4 Третичная структура - расположение полипептидной цепи в пространстве в виде компактной упаковки за счет взаимодействия боковых радикалов остатков аминокислот, удаленных друг от друга в линейной цепи.
Сгибы и петли придают ей определенную форму и составляют третичную структуру белка.
В образовании структуры наибольшее значение имеют связи:
ионные;
водородные;
гидрофобные;
ковалентные (дисульфидные)
1. Ионные (электростатические) связи возникает между отрицательно заряженными остатками аспарагиновой, глютаминовой кислот и положительно заряженными остатками аргинина, лизина, гистидина. Энергия - 42 кДж/моль, более прочные, чем водородные связи.
2. Гидрофобные остатки, выталкивая окружающую их воду, взаимодействуют друг с другом в основном внутри белковой молекулы.
3. При сближении –SH групп двух молекул цистеина, с последующим окислением образуются -S-S- связи;
Все эти взаимодействия между боковыми цепями аминокислот, часто находящихся на большом расстоянии друг от друга в линейной последовательности, определяют уникальную свернутую трехмерную форму белковой молекулы.
Определяется она рентгеноструктурным анализом и имеет большое значение для проявления активности ферментов
|
Молекулярная модель третичной структуры миоглобина
|


