
- •1 Вид пробы и пробоподготовка
- •2 Схема метода
- •2.1 Схема установки
- •2.2 Титрование с двумя индикаторными электродами
- •2.3 Типы реакций в амперометрическом титрировании
- •3 Приборы для амперометрического титрования
- •3.1 Описание прибора
- •3.2 Виды индикаторов
- •4 Область применения амперометрического титрования
Содержание
Введение…………………………………………………………………. |
3 |
1 Вид пробы и пробоподготовка……………………………………….
|
4 |
2 Схема метода………………………………………………………….. |
5 |
2.1 Схема установки……………………………………………………..
|
5 |
2.2 Титрование с двумя индикаторными электродами…………………
|
5 |
2.3 Типы реакций в амперометрическом титрировании……………….
|
6 |
3 Приборы для амперометрического титрования……………………… |
9 |
4 Область применения амперометрического титрования…………….. |
12 |
Заключение………………………………………………………………
|
13 |
Список литературы………………………………………………………
|
14 |
Введение
Амперометрическое титрование представляет собой объемный метод анализа, в котором для индикации конечной точки используется явление диффузионного тока, наблюдаемое на ртутном капельном или вращающемся платиновом электроде. Амперометрическое титрование сочетает объемные и полярографические методы анализа. Полярографический метод основан на пропорциональности между величиной диффузионного предельного тока электрода и концентрацией вещества, участвующего в электрохимическом процессе.
При полярографировании регистрируют изменения тока, проходящего через индикаторный ртутный электрод, при изменении потенциала. С увеличением отрицательного потенциала сначала происходит увеличение силы тока, характеризующее начало восстановления на катоде ионов металла, затем происходит эффект насыщения, вызванный местным уменьшением концентрации ионов данного металла вблизи ртутного электрода. Ионы металла, попадающие на электрод благодаря диффузии их через раствор, немедленно восстанавливаются. Скорость диффузии определяется разностью между концентрацией ионов металла в общем объеме раствора и концентрацией ионов металла на поверхности катода, где она равна нулю. Возникает участок кривой, где не происходит увеличения тока при изменении потенциала. Ток на этом участке кривой называется диффузионным током, последний линейно связан с концентрацией С ионов металла в растворе.
Для каждого металла существует определенный потенциал Ј/м, при котором наблюдается явление диффузионного тока.
Ряд точек этой зависимости находится па прямой линии, представленной уравнением, лежащим в основе полярографии:
U = КС,
где Id - диффузионный ток; С - концентрация ионов металла; К - коэффициент пропорциональности.
1 Вид пробы и пробоподготовка
Амперометрическое титрование позволяет выявить 10-6 г вещества в титруемом объёме. Методом амперометрического титрования определяют свыше 60 элементов в различных промышленных и природных материалах, в т.ч. рудах, горных породах и минералах, а также многие органические вещества, например, алкалоиды, альдегиды, амины, кетоны, органические кислоты, красители, сахара, фенолы и др.
При амперометрическом титровании можно добавлением титрапта снизить концентрацию ионов, дающих электродную реакцию, при этом снижается и величина диффузионного тока. Зависимость между количеством добавленного титраита и величиной диффузионного тока представляет собой кривую амперометрического титрования. Ряд характерных кривых амперометрического титрования показан на рис. 1.
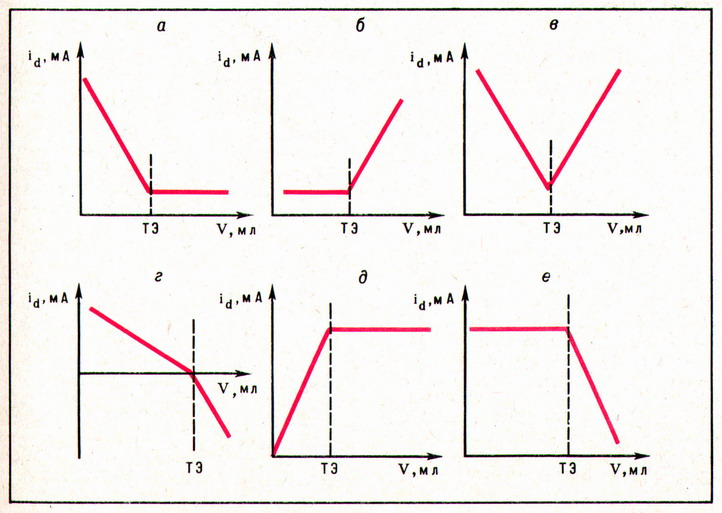
Рисунок 1 – кривые амперометрического титрования
2 Схема метода
2.1 Схема установки

Рисунок 2 - Схема амперометрической установки: 1- устройство для перемешивания раствора, совмещенное с индикаторным электродом (2); 3 – сосуд для титрования; 4 – промежуточный сосуд, препятствующий загрязнению электрода сравнения; 5- электрод сравнения; 6 – гальванометр; 7 и 11- контакты для замыкания электродов на гальванометр или контакты источника тока (8) с реостатом (9) и вольтметром (10).
При проведении амперометрического титрования на индикаторном электроде устанавливают потенциал, соответствующий области диффузионного тока того вещества, которое участвует в электродном процессе и концентрация которого меняется в процессе титрования.
2.2 Титрование с двумя индикаторными электродами
Разновидностью метода амперометрического титрования является титрование с двумя индикаторными электродами, к которым прикладывается небольшое постоянное напряжение, метод, известный в литературе под названием dead - stop titration или «биамперометрическое титрование». В отличие от потенциометрического титрования с двумя поляризующимися электродами, где в конечной точке резко меняется потенциал между электродами, при амперометрическом титровании с двумя индикаторными электродами резко меняется величина тока. Потенциал самих электродов при этом несколько изменяется. Если при потенциометрическом титровании в цепь электродов включают большое сопротивление, то чтобы получилось большее изменение тока, при амперометрическом титровании сопротивление в цепи электродов должно быть возможно меньшим.
Амперометрическое титрование с двумя индикаторными платиновыми электродами первоначально было применено при титровании йода, затем нашло применение и для определения других элементов. Физическая сущность метода заключается в следующем. Если в раствор погрузить одновременно два одинаковых платиновых электрода и приложить к ним постоянное напряжение, то в процессе титрования будет изменяться концентрация ионов, участвующих в реакции, а вместе с ней и сила тока.
2.3 Типы реакций в амперометрическом титрировании
2.3.1 Реакции осаждения
При определениях по методу осаждения первостепенное значение имеет растворимость образующегося соединения, так как от неё зависит полнота взаимодействия участников титрирования и чувствительность метода. Для осуществления титрований по методу осаждения необходимо, чтобы растворимость была меньше 10-4 моль/л. Если же осадки обладают заметной растворимостью (порядка 10-3 моль/л), то для понижения её титрования проводят в присутствии спирта или ацетона.
Необходимо также считаться и со скоростью образования осадка: обычно чем выше растворимость осадка, тем меньше скорость его образования. Если осадок образуется не мгновенно, то в первый момент после добавления титрующего раствора ток возрастет пропорционально количеству добавленного реактива и затем постепенно уменьшается по мере того, как происходит связывание добавленного реактива и образования осадка. В таких случаях не следует регистрировать первый, «бросковый» ток, а необходимо выждать, пока между раствором и осадком не установится равновесие, после чего сила тока примет постоянное значение.
При титровании по методу осаждения необходимо считаться ещё с тем, что состав образующегося соединения может зависеть от природы и кислотности фонового электролита. Так, 8-меркаптохинолин (тиооксин) с золотом (III в нейтральных и слабокислых (рН=3-6) растворах образует осадок Au (С6H6NS)3, а на фоне 1 М раствора HCI-HAu (C9H6NS)2Cl2.
Таким образом при титровании по методу осаждения необходимо не только считаться с растворимостью образующегося соединения, но и учитывать возможность влияния природы и кислотности титруемого раствора на состав образующихся осадков.
2.3.2 Реакции комплексообразования
Реакции образования устойчивых воднорастворимых комплексных соединений часто используют в амперометрическом титровании для определения различных элементов. В качестве комплексообразующего реагента-титранта наиболее широкое применение получил ЭДТА, который с ионами многих металлов образует прочные комплексы постоянного состава с отношением комплексообразования к лиганду 1:1. Образование и устойчивость комплексонатов зависит от природы катиона металла и кислотности раствора. Поэтому, варьируя рН тируемого раствора, можно осуществлять амперометрическое определение одних элементов в присутствии других, а также раздельное определение нескольких ионов при совместном их присутствии.
При титровании по методу комплексообразования необходимо учитывать возможность влияния природы и концентрации фона на протекание интересующей аналитика реакции, так как в растворах ионы металлов не существуют в «свободном» состоянии и находятся всегда в виде тех или иных комплексных ионов, в том числе в виде аквакомплексов. Если анионы фона способны образовывать с определяемым ионом металла комплексообразующим реагентом может не дать положительного результата. Поэтому при проведении химических реакций необходимо принимать во внимание возможность влияние тех или иных факторов на полноту и стехиометрию реакции.
2.3.3 Реакции окисления-восстановления
При титровании по методу окисления- восстановления также необходимо, чтобы взаимодействие участников титрования протекало количественно и быстро. О возможности и направлении протекания таких реакций обычно судят, исходя из значений стандартных (нормальных) потенциалов. Стандартные потенциалы характеризуют окислительно-восстановительные системы в идеальных условиях, т.е при активности потенциалопределяющих ионов равной единице, отсутствии посторонних ионов и т.д. Практически такие условия неосуществимы, наоборот- в реальных условиях приходится иметь дело с растворами, содержащими те или иные ионы, которые могут оказывать влияние на значение окислительно-восстановительного потенциала данной системы. Особенно сильно на окислительно-восстановительные потенциалы влияют посторонние вещества, способные выступать в качестве лигандов или изменять форму существования потенциалопределяющих ионов.
