
- •Кафедра «химия и общая химическая технология»
- •Основы кинетики химических реакций
- •Канд. Хим. Наук, доцент о.М. Иванкина
- •1. Основные понятия химической кинетики
- •2. Зависимость скорости реакции от концентрации реагентов
- •3. Зависимость скорости реакции от температуры
- •Исходные Активированный Продукты
- •4. Влияние катализаторов на скорость реакции
- •5. Химическое равновесие. Принцип Ле-Шателье-Брауна
- •Лабораторная работа
- •2. Влияние температуры на скорость реакции
- •3. Влияние катализатора на скорость реакции
- •Химическое равновесие
- •Список рекомендуемой литературы
- •400131, Г. Волгоград, пр. Ленина, 28, корп. 1.
5. Химическое равновесие. Принцип Ле-Шателье-Брауна
Изучение зависимости скоростей химических реакций от различных факторов имеет большое практическое значение, потому что помогает управлять ими, но информация о реакции не будет полной без рассмотрения состояния химического равновесия, которое является составной частью термодинамики, и его количественной характеристики - константы равновесия.
При протекании химической реакции концентрации исходных веществ уменьшаются; в соответствии с законом действия масс это приводит к уменьшению скорости реакции. Если реакция обратима, то есть может протекать как в прямом, так и в обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. Для равновесных процессов в общее уравнение скорости реакции помимо констант скоростей прямого и обратного процессов входит и константа равновесия, количественно характеризующая состояние химического равновесия.
Гомогенное равновесие: реагенты находятся в одной фазе (газовой или жидкой).
Гетерогенное равновесие: реагенты находятся в разных фазах.
В случае обратимой химической реакции:
аA + bB cC + dD.
Зависимость скоростей прямой ( ) и обратной ( ) реакций от концентраций реагирующих веществ выражается соотношениями:
= k [A]a [B]b;
= k [C]c [D]d.
В состоянии химического равновесия = , то есть k[A]a[B]b=k[C]c[D]d. Отсюда:
![]() , (9)
, (9)
где Кс – константа равновесия, выраженная через концентрации реагентов и продуктов реакции.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями и обозначаются квадратными скобками ([СО2], [HCl]), они имеют размерность моль/л.
В случае реакций между газами, концентрацию каждого из них можно заменить парциальным давлением, тогда:
 . (10)
. (10)
Значения Кс и Кр постоянны для каждой температуры.
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газовой фазе, так как концентрации твердых веществ остаются постоянными.
Катализатор не влияет на значение константы равновесия, поскольку он снижает энергию активации прямой и обратной реакции на одну и ту же величину и поэтому одинаково изменяет скорости прямой и обратной реакций. Катализатор лишь ускоряет достижение равновесия, он не влияет на количественный выход продуктов реакции.
Пример 6.
В системе 2 NO
(Г) +
O2
(Г)
2 NO2
(Г) равновесные
концентрации равны: [NO]
= 0,05 моль/л, [O2]
= 0,12 моль/л, [NO2]
= 0,3 моль/л. Найти константу равновесия
реакции и исходные концентрации веществ
[NO]
и [O2].
системе 2 NO
(Г) +
O2
(Г)
2 NO2
(Г) равновесные
концентрации равны: [NO]
= 0,05 моль/л, [O2]
= 0,12 моль/л, [NO2]
= 0,3 моль/л. Найти константу равновесия
реакции и исходные концентрации веществ
[NO]
и [O2].
Решение:
Константа равновесия данной реакции выражается уравнением:
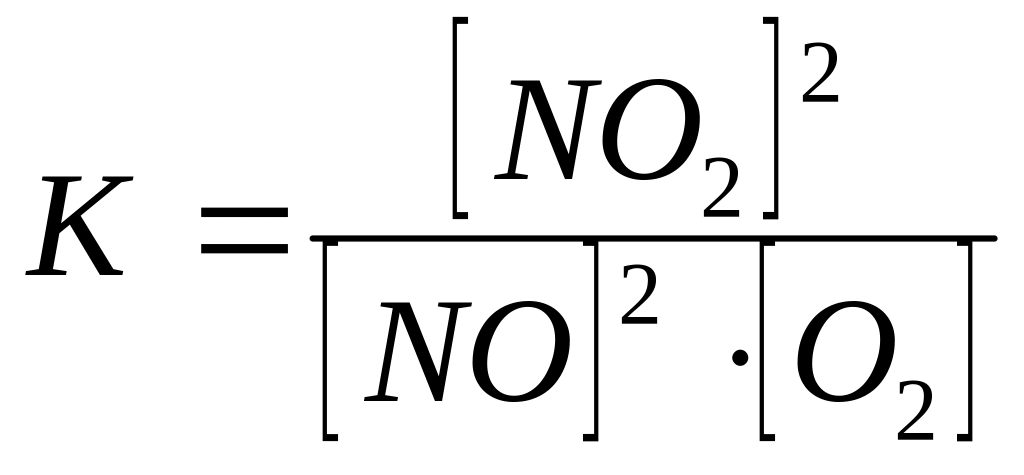 .
.
Подставляя данные задачи в него, получаем:
![]()
Для нахождения исходных концентраций NO и O2 учтем, что согласно уравнению реакции из 1 моля O2 и двух молей NO образуется 2 моля NO2.
[NO]0 = 0,05 + 0,3 = 0,35 моль/л,
[O2]0 = 0,12 + 0,3/2 = 0,28 моль/л.
Пример 7. Константа равновесия системы при некоторой температуре равна 0,5:
F eO (k) + CO (Г) Fe (k) + CO2 (Г).
Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли [CO]0 = 0,05 моль/л, [CO2]0 = 0,01 моль/л.
Решение:
Поскольку FeO и Fe – твердые вещества, их концентрации остаются постоянными и не входят в выражение константы равновесия:
![]() .
.
Выразим равновесные концентрации веществ через исходные и уменьшение концентрации СО к моменту наступления равновесия.
Пусть х – это уменьшение концентрации СО. Тогда равновесная концентрация [CO ]= [CO]0-x = (0,05-x) моль/л. Из уравнения реакции видно, что из одного моля СО образуется 1 моль СО2. Следовательно, равновесная концентрация [CO2] = [CO2]0 + x = (0,01+x) моль/л.
Для вычисления х подставим числовые значения равновесных концентраций в выражение константы равновесия:
![]()
х = 0,01 моль/л
[CO2] = [CO2]0 + x = 0,01 + 0,01 = 0,02 моль/л.
[CO] = [CO]0 – x = 0,05 – 0,01 = 0,04 моль/л.
Пример 8. В закрытом сосуде смешано 6 молей СО и 3 моля О2. Реакция протекает при постоянной температуре. К моменту наступления равновесия в реакцию вступает 70 % первоначального количества О2. Определить давление газовой смеси при равновесии, если исходное давление составляло 280 кПа.
Решение:
2 СО (Г) + О2 (Г) 2 СО2 (Г), H < 0 (экзотермическая)
Согласно условию задачи, в реакцию вступило 70 %, то есть 2,1 моля О2, а осталось неизрасходованным 0,9 моль О2. По уравнению реакции на каждые моль О2 расходуется 2 моля СО, причем образуется 2 моля СО2. Следовательно на 2,1 моля О2 в реакцию вступило 4,2 моля СО и образовалось 4,2 моля СО2, осталось неизрасходованным 6 – 4,2 = 1,8 моль СО.
До протекания реакции общее число молей составляло 6 + 3 = 9 моль, а после достижения равновесия 0,9 + 1,8 + 4,2 = 6,9 моль.
В закрытом сосуде при постоянной температуре давление газовой смеси пропорционально общему количеству составляющих ее газов. Следовательно, давление Р при равновесии определится:
![]() кПа.
кПа.
При изменении условий протекания реакций (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. В результате устанавливается новое химическое равновесие, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье-Брауна:
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в сторону уменьшения этого воздействия:
1) при повышении давления равновесие смещается в сторону уменьшения числа молей газообразных веществ; при понижении давления равновесие смещается в сторону увеличения числа молей газообразных веществ;
2) при повышении температуры равновесие смещается в сторону эндотермической реакции; при понижении температуры равновесие смещается в сторону экзотермической реакции;
3) при увеличении концентрации одного из реагентов равновесие смещается в сторону прямой реакции; при уменьшении концентрации одного из реагентов равновесие смещается в сторону обратной реакции.
Константа равновесия химической реакции связана со стандартным изменением энергии Гиббса этой реакции GT уравнением:
GT0 = -2,3 RT lg KT = - RTlnKp .
При Т = 298 К (25 0С) это уравнение преобразуется к виду:
G2980 = - 5,69 lg K298, G2980 выражено в кДж/моль.
Равновесие смещено вправо:
К >1, lg K > 0, G2980 < 0, то
равновесие смещено влево:
К < 1, lg K < 0, G2980 > 0.
