
- •1.Потребительская стоимость товара — предмет товароведения
- •2. Содержание товароведения
- •3. Методы товароведения
- •4. Задачи товароведения
- •5. Связь товароведения с другими науками и научными дисциплинами
- •6.Классификация методов контроля
- •7. Органолептический метод
- •8. Определение общей и активной кислотности
- •10. Определение содержания сахаров
- •11. Определение содержания клетчатки
- •17. Определение содержания жира в аппарате Сокслета.
- •21. Значение воды для организма человека
- •22. Содержание воды в пищевых продуктах
- •23. Формы связи воды с сухим веществом
- •24. Гигроскопичность пищевых продуктов
- •27. Макроэлементы
- •28. Микроэлементы
- •30.Загрязнение пищевых продуктов вредными и ядовитыми веществами.
- •31. Роль углеводов в питании и содержание их в пищевых продуктах
- •32. Основы фотосинтеза углеводов растениями
- •33. Классификация и характеристика углеводов
- •34. Моносахариды
- •35. Полисахариды первого порядка.
- •45. Значение жиров в питании и содержание их в пищевых продуктах
- •46. Химический состав жиров
- •47. Свойства жиров
- •48. Процесы протекающие в жирах.
- •49. Липоиды
- •50. Значение белков в питании и содержание их в пищевых продуктах
- •51. Свойства белков
- •52. Классификация белков
- •53. Полноценные и неполноценные белки
- •54. Небелковые азотсодержащие вещества
- •57. Номенклатура ферментов
- •60. Значение ферментов
- •64. Химическая природа и биологическая роль жирорастворимых витаминов
- •65. Витаминоподобные вещества и антивитамины
- •68. Органические кислоты
- •69. Фенольные соединения
- •70. Полимерные фенольные соединения
- •71. Ароматобразующие соединения
- •72. Красящие вещества
- •75. Усвояемость
- •80. Теплофизические свойства
- •81. Сорбционные свойства
- •82. Показатели качества пищевых продуктов
- •83. Уровень качества
- •84. Зависимость качества от различных факторов.
- •85. Виды дефектов
- •86. Разрушительные агенты продовольственных товаров
- •87. Процессы, протекающие при хранении продовольственных товаров, и их влияние па качество
- •88. Количественные потери пищевых продуктов
- •89. Пути сокращения потерь и сохранения
- •90. Консервирование как способ удлинения сроков хранения
- •92. Физико-химические методы
- •93. Биохимические методы
- •94. Химические методы
- •7. Мясные товары.
- •8. Яичные товары.
- •9. Рыбные товары.
- •100. История.
- •102. Создание упаковки и тары
- •103. Классификация тары и упаковки
- •105. Деревянная тара
- •106. Текстильная тара
- •107. Стеклянная тара
- •108. Металлическая тара
- •109. Картонно-бумажная тара
- •110. Полимерная тара
- •111. Многослойные и комбинированные плёночные материалы
- •112. Способы упаковывания пищ. Прод.
- •113. Тара и упаковка и окружающая среда
- •114. Радиоактивность и виды радиоактивных распадов
- •115. Единицы радиоактивности
- •116.Фотопластинка в роли детектора излучения
- •117.Ионизационные камеры
- •118.Пропорциональные счетчики
- •119.Полупроводниковые детекторы
- •120. Естественная радиация и медицина
- •121. Загрязнения окр. Среды в рез-те ядерных взрывов.
- •122. Авария на промышленных реакторах. Чернобыль
- •123. Как образовались пятна радиоактивности
- •124. Характер загрязнения территории рб
- •125. Загрязнение воды, лесов, и лугов.
- •126. Проблема трансурановых загрязнений
- •128. Накопление и распределение радионуклидов в организме животных
- •129. Радиоактивность в человеческом организме
- •130. Механизм действия ионизирующих излучений на человеческий организм.
- •131. Химические радиопротекторы
- •132. Агрохимические, агротехнические, зоотехнические мероприятия по уменьшению загрязнения пищевых продуктов
- •133. Технологическая обработка пищевых продуктов для уменьшения их загрязнений радионуклидами
- •134.Радиационная гигиена
54. Небелковые азотсодержащие вещества
Небелковые азотсодержащие вещества пищевых продуктов представлены аминокислотами, аммиаком и его производными, пуриновыми азотистыми основаниями, амидами кислот, нитритами, нитратами, алкалоидами. Многие из них являются промежуточными или конечными продуктами белкового обмена растительных и животных организмов и имеют важное биологическое значение. Небелковые азотсодержащие вещества участвуют в образовании специфического вкуса и аромата продуктов. При варке продуктов они переходят в бульон и, видоизменяясь, сообщают ему аромат и вкус. Некоторые из них стимулируют деятельность пищеварительных желез. Из общего содержания азотсодержащих веществ на долю небелковых азотсодержащих соединений приходится 6,5—10 % в мясе животных, 8—38 % — в рыбе, 1,7—30 % —в плодах и овощах. Количество их в продуктах зависит также от степени ферментативного и неферментативного гидролиза белков, происходящего во время переработки и хранения товаров. Свободные аминокислоты находятся в растительных и животных тканях в малых количествах: в свежем мясе —
100-720 мг%, в водорослях — 150—270 мг%. При хранении продуктов их количество увеличивается. Так, в свежеубном картофеле содержится аминокислота тирозин —5-10 мг%. а после семи месяцев хранения — до 40—45 мг%.
Амиак и его органические производные, в частности амины, находятся в продуктах в незначительйых количестве. Повышенное их содержание свидетельствует о гнилостном распаде белков. Например, в живой рыбе имеется 3—9 мг% аммиака, во время хранения его количество возрастает. М е т и л а м и н ы накапливаются в мясе и рыбе в результате разложения липопротеидов и придают продуктам неприятный запах. При гниении белков образуются и ядовитые для человека амины — к а д а в е р и н (из аминокислоты лизина), п у т р е с ц и н (из орнитина), г и с т а м и н (из гис-
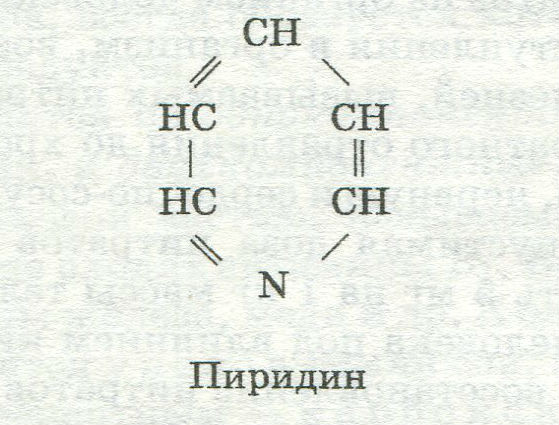
тидина). Пуриновые азотистые основания содержатся во многих вкусовых товарах. К ним относятся д и м е т и л к с а н т и н , известный под названием т е о б р о м и н (в какао, шоколаде), и т р и м е т и л к с а н т и н , или к о ф е и н (в кофе, чае). Пиридин и его производные входят в состав витаминов В, РР и др., вкусовых продуктов (перец, табак), ДНК, РНК:
Амиды кислот являются производными жирных кислот, распространены в животных и растительных продуктах. Из амидов кислот аспарагин в большом количестве находится в спарже, капусте (до 0,32 % ) , г л у т а м и н — в свекле (0.5 % ) , горохе, сладком перце и др. Эти амиды образуются в растительных и животных организмах в результате связывания аспарагиновой и глутаминовой кислот с NНз, образующимся в процессе обмена веществ. Амид мочевины (амид угольной кислоты):
содержится в мясе акул и скатов (2000—2750 мг%) и придает ему неприятный запах.
Нитриты (NaNO2) добавляют в мясо при производстве колбасных изделий, мясных копченостей, солонины для сохранения розово-красной окраски готовых продуктов. Санитарным законодательством Республики Беларусь установлена предельно допустимая норма содержания нитритов, поскольку они оказывают вредное влияние на организм человека. При повышенном их содержании в продуктах образуются н и т р о з а м и н ы (взаимодействие нитритов с вторичными аминами в присутствии водорода):
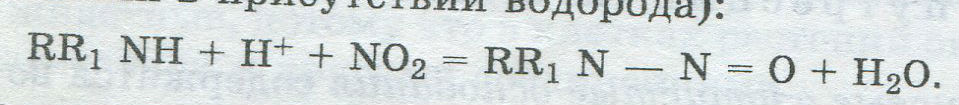
Нитрозамины очень опасны, так как обладают токсическим и канцерогенным действием. Нитраты находятся в некоторых растительных продуктах: крапиве (до 5 % КМОз в переводе на сухое вещество), тыкве, кабачках и др. Влияние нитратов на организм человека зависит от дозы, длительности поступления в организм, возраста человека и т.д. Перечень болезней, вызываемых нитратами, весьма обширен — от нитратного отравления до хронического действия на иммунную, нервную и сердечно-сосудистую системы. Предельно допустимая доза нитратов для человека не должна превышать 5 мг на 1 кг массы тела. В организме человека под влиянием кишечной микроф лоры происходит восстановление нитратов в нитриты, которые всасываются в кровь и блокируют центры дыхания. Кроме того, при продолжительном хранении овощей, особенно с высоким исходным содержанием нитратов, некоторая
 часть
их переходит в нитриты. Предельно
допустимая концентрация нитратов для
белокочанной капусты составляет 500
мг/кг, картофеля — 250, свеклы — 1400 мг/кг.
часть
их переходит в нитриты. Предельно
допустимая концентрация нитратов для
белокочанной капусты составляет 500
мг/кг, картофеля — 250, свеклы — 1400 мг/кг.
55. Строение и свойства ферментов — это вещества белковой природы, катализирующие процессы распада и синтеза в животных и растительных организмах. Они играют огромную роль в процессах питания и обмена веществ. Не меньшее значение имеют ферменты в процессах хранения и производства пищевых продуктов.
По характеру своего действия ферменты относятся к биокатализаторам и вырабатываются только в клетках животных, растений и микроорганизмов, но проявляют свое действие не только в клетках, но и будучи выделенными из них. В настоящее время из биологических объектов выделено около 3500 и изучено несколько сотен ферментов. Полагают, что живая клетка может содержать более1000 различных ферментов. Каждый фермент, как правило, катализирует только один тип химической реакции. При этом катализируемые в организме ферментативные реакции не сопровождаются образованием побочных продуктов, в то время как в органических реакциях, проводимых с помощью искусственных катализаторов, всегда образуется хотя бы один или несколько таких продуктов.
Ферменты делятся на однокомпонентные, являющиеся простыми белками, и двухкомпонентные, в которых белок соединен с небелковой частью, называемой коферментом. В состав ферментов входят витамины B1, В2, В3, В6, РР и др., нуклеотиды, атомы железа, меди и др. К однокомпонентным ферментам относятся у р е а з а семян сои, амилаза солода и др., к двухкомпонентным — карбоксилаза, каталаз а и др.
Будучи белковыми веществами, ферменты находятся в коллоидном состоянии, при нагревании и добавлении солей тяжелых металлов инактивируются, являются амфотерными электролитами, высаливаются при добавлении к их растворам нейтральных солей. Для ферментов характерна специфичность действии, высокая каталитическая активность. Специфичность действия заключается в том, что каждый фермент действует на вещество определенного структурного характера, например фермент сахараза катализирует только сахарозу.
Каталитическая активность ферментов огромна и во много раз превышает активность неорганических катализаторов. Так, для расщепления белков до аминокислот с помощью 25 % серной кислоты при кипячении необходим 20 часов, а под действием фермента трипсина в организме человека этот процесс проходит за 2—3 часа. Ферменты сохраняют аЯ тивность при больших разведениях. Так, пероксидаза действует при разведении 1:5 ООО ООО.
56. Факторы, влияющие на деятельность ферментов.
На активность ферментов влияют температура, рН среды, влажность и присутствие некоторых химических веществ. Для каждого фермента существует оптимальная температура. Для большинства из них благоприятной температурой является 30—50 °С. При нагревании свыше 80 °С ферменты разрушаются, при низких (минусовых) температурах активность их резко понижается. Поэтому скоропортящиеся продукты (мясо, рыба, яйца и др.) хранят в охлажденном и замороженном состоянии. При низких (минусовых) температурах ферменты действуют, если не вся вода продукта превратилась в лед. Например, липаза не теряет активность при -24 °С. После размораживания ее активность значительно выше первоначальной (до замораживания). Очевидно, плохая сохраняемость размороженных продуктов происходит в результате активизации ферментов.
Оптимальная величина рН для ферментов разная. Так, для мальтазы она равна 6,5—7,2, липазы — 7—7,5, пепсина который выделяется в сильнокислотную среду желудка, — 1,5 - 2,5. Незначительные сдвиги значения рН замедляют и прекращают действие ферментов.
Повышение содержания влаги в продукте до определенного момента усиливиет деятельность фермента, поэтому, например, интен-'ишюсть дыхания влажного зерна выше, чем сухого.
На активность ферментов влияет присутствие в растворах некоторых химических веществ. Одни из них повышают активность ферментов и называются активаторами, другие понижают активность и называются ингибиторами-парализаторами. Например, этилен ускоряет, а углекислый газ замедляет ферментативные процессы дозревания яблок, груш. Активаторами ферментов являются ионы метал-Na+, К+, Rb+, Mg2+, Са2+, Cu2+, Fe2+ и соединения, содержащие сульфгидрильные группы SH, а также HCN, H2S. Ингибиторами ферментов являются соли тяжелых металлом, осаждающие ферменты, и вещества, ослабляющие действие ферментов, например окислители Н2О2 и бромат калия, тормозящие действие протеаз.
Специфические ингибиторы действуют только на определенные ферменты. Так, синильная кислота действует только на окислительные ферменты, содержащие в актином центре железо или медь. Синильная кислота вступает в соединение с металлами, и фермент теряет активность.
Сущность действия ингибиторов в большинстве случаев состоит в том, что они соединяются с активными группами или активными центрами молекулы фермента.
Активность ферментов зависит от состояния вещества, на которое они оказывают действие. Так, денатурированные белки быстрее гидролизуются, чем те же белки в коллоидном состоянии; разрушенные крахмальные зерна гидролизуются быстрее, чем целые, и т.д.
