
- •1.Потребительская стоимость товара — предмет товароведения
- •2. Содержание товароведения
- •3. Методы товароведения
- •4. Задачи товароведения
- •5. Связь товароведения с другими науками и научными дисциплинами
- •6.Классификация методов контроля
- •7. Органолептический метод
- •8. Определение общей и активной кислотности
- •10. Определение содержания сахаров
- •11. Определение содержания клетчатки
- •17. Определение содержания жира в аппарате Сокслета.
- •21. Значение воды для организма человека
- •22. Содержание воды в пищевых продуктах
- •23. Формы связи воды с сухим веществом
- •24. Гигроскопичность пищевых продуктов
- •27. Макроэлементы
- •28. Микроэлементы
- •30.Загрязнение пищевых продуктов вредными и ядовитыми веществами.
- •31. Роль углеводов в питании и содержание их в пищевых продуктах
- •32. Основы фотосинтеза углеводов растениями
- •33. Классификация и характеристика углеводов
- •34. Моносахариды
- •35. Полисахариды первого порядка.
- •45. Значение жиров в питании и содержание их в пищевых продуктах
- •46. Химический состав жиров
- •47. Свойства жиров
- •48. Процесы протекающие в жирах.
- •49. Липоиды
- •50. Значение белков в питании и содержание их в пищевых продуктах
- •51. Свойства белков
- •52. Классификация белков
- •53. Полноценные и неполноценные белки
- •54. Небелковые азотсодержащие вещества
- •57. Номенклатура ферментов
- •60. Значение ферментов
- •64. Химическая природа и биологическая роль жирорастворимых витаминов
- •65. Витаминоподобные вещества и антивитамины
- •68. Органические кислоты
- •69. Фенольные соединения
- •70. Полимерные фенольные соединения
- •71. Ароматобразующие соединения
- •72. Красящие вещества
- •75. Усвояемость
- •80. Теплофизические свойства
- •81. Сорбционные свойства
- •82. Показатели качества пищевых продуктов
- •83. Уровень качества
- •84. Зависимость качества от различных факторов.
- •85. Виды дефектов
- •86. Разрушительные агенты продовольственных товаров
- •87. Процессы, протекающие при хранении продовольственных товаров, и их влияние па качество
- •88. Количественные потери пищевых продуктов
- •89. Пути сокращения потерь и сохранения
- •90. Консервирование как способ удлинения сроков хранения
- •92. Физико-химические методы
- •93. Биохимические методы
- •94. Химические методы
- •7. Мясные товары.
- •8. Яичные товары.
- •9. Рыбные товары.
- •100. История.
- •102. Создание упаковки и тары
- •103. Классификация тары и упаковки
- •105. Деревянная тара
- •106. Текстильная тара
- •107. Стеклянная тара
- •108. Металлическая тара
- •109. Картонно-бумажная тара
- •110. Полимерная тара
- •111. Многослойные и комбинированные плёночные материалы
- •112. Способы упаковывания пищ. Прод.
- •113. Тара и упаковка и окружающая среда
- •114. Радиоактивность и виды радиоактивных распадов
- •115. Единицы радиоактивности
- •116.Фотопластинка в роли детектора излучения
- •117.Ионизационные камеры
- •118.Пропорциональные счетчики
- •119.Полупроводниковые детекторы
- •120. Естественная радиация и медицина
- •121. Загрязнения окр. Среды в рез-те ядерных взрывов.
- •122. Авария на промышленных реакторах. Чернобыль
- •123. Как образовались пятна радиоактивности
- •124. Характер загрязнения территории рб
- •125. Загрязнение воды, лесов, и лугов.
- •126. Проблема трансурановых загрязнений
- •128. Накопление и распределение радионуклидов в организме животных
- •129. Радиоактивность в человеческом организме
- •130. Механизм действия ионизирующих излучений на человеческий организм.
- •131. Химические радиопротекторы
- •132. Агрохимические, агротехнические, зоотехнические мероприятия по уменьшению загрязнения пищевых продуктов
- •133. Технологическая обработка пищевых продуктов для уменьшения их загрязнений радионуклидами
- •134.Радиационная гигиена
50. Значение белков в питании и содержание их в пищевых продуктах
Белковые вещества, или белки, представляют собой природные высокомолекулярные азотсодержащие органические соединения, очень сложные молекулы которых построены из остатков α-аминокислот.
Значение белков в природе исключительно велико, поскольку они играют первостепенную роль во всех явлениях жизни. «Жизнь есть способ существования белковых тел». Белки широко распространены в природе. Особенно много их содержится в организме животных и человека. В растениях их количество значительно меньше. В то же время только в растениях наряду с синтезом углеводов осуществляется синтез белков из СО2, минеральных азотсодержащих соединений и воды. В животные организмы белки поступают в готовом виде — с растительной и животной пищей. В процессе пищеварения под влиянием ферментов они расщепляются до α-аминокислот, которые усваиваются организмом и расходуются на синтез необходимых (специфичных) для данного организма белков с помощью нуклеиновых кислот. Протоплазма и ядра живых клеток состоят в основном из белков. Большое их количество находится также в костях, хрящах, мышцах, нервных тканях, волосах, чешуе рыб, рогах, ферментах и т.д. Помимо участия в построении тканей и
синтезе веществ организма, белки служат источником энергии но только в том случае, если с пищей их поступает достаточное количество или она бедна углеводами и жирами. Таким образом, белковые вещества — важнейшая составная часть пищи человека и животных наряду с жирами и углеводами. Оптимальная суточная норма белка для взрослого человка составляет 100—120 г. Правильным считается соотношение в пище белков, жиров и углеводов 1:1:4. Среднее содержание белков в пищевых продуктах следующее: в сое — 33—44 %, икре рыб — 26, сыре — 18—25, горохе — 22,4, твороге обезжиренном — 17,5, мясе — 14—21, рыбе — 13—18, яйцах — 12,5, пшенице — 10—18, ржи — 11, хлебе пшеничном — 6,8—7,8, молоке — 3, плодах и ягодах - 0,2—1,5, овощах — 0,5—6,5, картофеле — 2,0, масле сливочном — 0,5, дрожжах кормовых — 45—50 %. В белках дрожжей в достаточном количестве находятся незаменимые кислоты, что подтверждает их большую питательную ценность. По элементарному составу белки незначительно отлипаются один от другого. Содержание в них углерода составляет 50,6—54 %, кислорода — 21,5—23,5, водорода — 6,5—7,3, азота — 15—18,4, серы — 0,3—2,5 %. В состав молекул некоторых белков входят железо, йод, фосфор, медь, кальций, магний.
51. Свойства белков
Специфические свойства и пищевая ценность различных белков определяются их строением и аминокислотным составом. Основу молекул белков составляет одна, несколько или большое количество полипептидных цепей, каждая из которых, в свою очередь, складывается из многих десятков и сотен остатков аминокислот, соединенных прочной (ковалентной) пептидной связью:
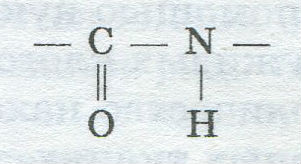
Последняя образуется при взаимодействии карбоксильной группы одной аминокислоты с аминогруппой другой:

Последовательность аминокислот, соединенных друг с другом пептидными связями, характеризует первичную структуру белка. Молекулярная масса белков колеблется от 6000 до 1 млн и более. Белок с М = 6000 содержит - 51 аминокислотный остаток. Молекулы некоторых белков состоят из одного или нескольких полипептидов. Соединяясь друг с другом, полидептидные цепи в результате образования различных связей
образуют вторичную структуру белка, обычно в форме спирали. Она образуется за счет водородных связей между кислородом и водородом. Спирали и нити вторичной структуры, а также неупорядоченные участки полипептидных цепей могут складываться, образуя своеобразные клубки, таким образом создается третичная структура белка. Она характеризуется
внутримолекулярными взаимодействиями различного типа. При этом могут возникать водородные, а также дисульфидные связи –СН2—S—S—СН2—, вандервальсовские силы между боковыми радикалами аминокислот. Несколько «клубков» третичной структуры в некоторых белках ассоциируются, образуя еще более сложную четвертичную структуру белка. В зависимости от укладки пептидных цепей в молекулах различают белки глобулярные и фибриллярные. Белки, имеющие форму сильно скрученной, сферической и эллиптической спирали, называются глобулярными. Они находятся в молоке, сыворотке крови, тканях животных; растворяются в воде и слабых растворах. Белки в виде развернутой спирали, нитевидные, волокнистые носят название фибриллярных. Они встречаются в мышцах, сухожилиях; в большинстве случаев не растворяются в воде. К фибриллярным белкам относятся коллаген, желатин, кератин, миозин, к глобулярным — альбумины, глобулины. Белки являются аморфными веществами, представляющими собой высокомолекулярные коллоиды, но некоторые из них удалось выделить из растворов в кристаллическом виде: яичный и молочный альбумин, казеин, гемоглобин н др. Однако кристаллы этих белков отличаются от обычных кристаллов, они способны набухать и удерживать воду и примеси, т.е. ведут себя как коллоиды.
Одним из важнейших свойств белков является их способность к набуханию. Безводный сухой белок поглощает большое количество воды (до 300 % к сухому весу). Это явление называется набуханием геля. В гелях вода окружает частицы коллоидов и находится в капиллярных пространства между ними, прочно связываясь с белком. Набухание белков
зависит от рН, присутствия солей, снижающих обычно способность белка к набуханию. Наименьшей способностью к набуханию белки обладают в изоэлектрической точке, когда величина рН среды такова, что электрический заряд частиц белка равен нулю. Процесс набухания белков имеет большое значение при переработке пищевых продуктов и их использовании — при замесе теста, приготовлении макарон и т.д. Во время хранения продуктов происходит старение белков. По мере старения белок постепенно теряет способность к набуханию, снижается его растворимость и способность к гидролизу. Старение белков проявляется при длительном хранении богатых белками продуктов (например, бобовых). В результате старения продукты приобретают жесткую консистенцию, плохо развариваются и усваиваются. При старении набухшего белка происходит отделение воды от набухаюшего геля — синерезис.
Структуры белков лабильны: под влиянием тех или иных факторов (нагревания, химических реактивов и др.) в макромолекулах белков изменяются вторичные, третичные и четвертичные структуры, причем пептидные и дисульфидньи связи могут оставаться без изменений. В результате этого появляется новый белок, отличающийся от природного физико-химическими и биологическими свойствами. Так, при нагревании растворов белков до 70—100 °С, белка казеина - свыше 100 °С, а также при воздействии на белок сильных кислот и щелочей, солей тяжелых металлов (свинец, медь), ионизирующей радиации, ультрафиолетовых лучей, ультразвуковых волн происходит денатурация — необратимая коагуляция
с нарушением вторичной, третичной и четвертичной структур белка. При денатурации белков снижается их способность вновь растворяться в воде и солевых растворах. При тепловой денатурации глобулярных белков вязкость их повышается, при этом глобулы выпрямляются и приобретают нитевидную форму. Вязкость фибриллярных белков, наоборот. уменьшается, так как происходит скручивание пептидных цепей. Тепловая денатурация белков имеет большое значение и производстве ряда пищевых продуктов — выпечке хлеба изготовлении мясных и рыбных товаров и т.д. Скорость денатуляции белков пищевых продуктов при обработке находится в прямой зависимости от содержания в них воды и кислот, а также от температуры и продолжительности нагревания. Не все белки при нагревании свертываются, например коллаген при нагревании в воде растворяется, превращаясь в желатин. Денатурация белков наблюдается и при длительном хранении некоторых продуктов, например семян бобовых, в которых белки по мере старения теряют способность к набуханию. Не связанным с денатурацией процессом является высаливание белков, заключающееся в том, что при добавлении к раствору белка концентрированных растворов солей достигается изоэлектрическое состояние, и белок выпадает в осадок, но не подвергается денатурации и может быть растворен. В этом случае он не изменяет своих свойств.
