
- •2.2. Природа хімічних зв’язків
- •2.3. Ковалентні зв’язки атомІв вуглецю
- •Між атомами вуглецю
- •2.4. Квантово-механічний опис молекул
- •Метод валентних зв’язків (вз)
- •Метод молекулярних орбіталей (мо)
- •2.5. Теорія взаємного впливу атомів у молекулах органічних речовин
- •Індукційний ефект
- •Мезомерний ефект (ефект спряження, резонансний ефект)
- •Ефект надспряження (гіперкон’югації)
2.5. Теорія взаємного впливу атомів у молекулах органічних речовин
Оскільки хімічні реакції є процесами, в яких відбувається розщеплення одних зв’язків та утворення інших, то напрямок хімічної реакції суттєво залежить від розподілу електронної густини в молекулах реагуючих речовин.
Електрони не розподілені рівномірно по всій молекулі. Навіть в формально нейтральних молекулах є місця з підвищеним негативним зарядом і є місця з підвищеним позитивним зарядом. Отже молекули, а також у більшій чи меншій мірі поляризовані. Розподіл електронної густини в молекулі залежить від взаємного впливу атомів.
Найефективніше впливають один на одного безпосередньо зв`язані атоми. Характер їх взаємного впливу проявляється в природі хімічного зв`язку між ними. Але навіть безпосередньо незв`язані атоми також впливають один на одного і цей вплив здійнюється за допомогою так званих електронних ефектів. Розглянеми найбільш вагомі з них.
Індукційний ефект
Індукційний ефект – це перерозподіл електронної густини σ-зв`язків за рахунок їх поляризації. Розглянемо його прояв на такому прикладі: нехай в органічній речовині з атомом вуглецю з`єднаний більш електронегативний замісник Х. Спільна електронна пара зв`язку С—X зсунута до замісник Х, в результаті чого він набуває часткового негативного заряду (δ–), а зв`язаний з ним атом вуглецю – позитивного (δ+).
Атом вуглецю, від якого замісник Х відтягнув електрони, стає більш електронегативним і починає відтягувати електронну густину від інших сусідніх атомів, наводячи на них так само часткові позитивні заряди. Але величини цих зарядів будуть вже значно меншими. За таким самим механізмом індукуються (наводяться) позитивні заряди і на інших атомах, але їх величини будуть ще меншими (δδδ+).
Отже, замісник Х індукує виникнення позитивних зарядів на атомах, що безпосередньо з ним не зв`язані. В цьому випадку говорять, що Х проявляє негативний індукційний ефект (─І-ефект). Прояв ─І-ефекту буде тим сильнішим, чим більша електронегативність замісника Х.
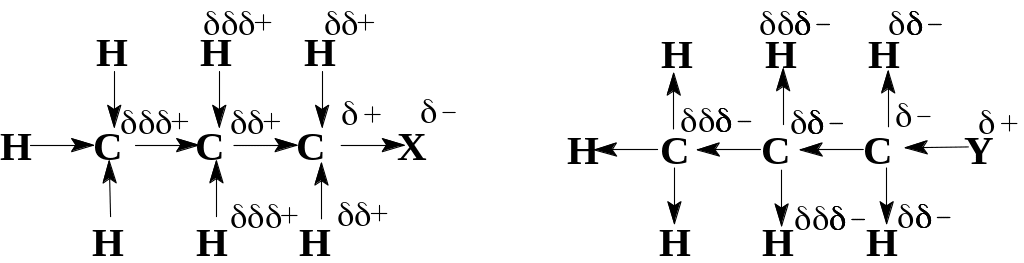
Замісники, які проявляють ─І–ефект
До цих замісників відносять елементи більш електронегативні, ніж вуглець (Hal, N, O тощо) або групи атомів з повним позитивним зарядом на атомі, що безпосередньо сполучений з вуглецем. Всі без виключення ненасичені замісники з атомами вуглецю в sp2-, чи sp-гібридному стані, також виявляють ─І-ефект. За здатністю виявляти ─І-ефект замісники, що найчастіше зустрічаються при вивченні курсу органічної хімії, зустрічаються при вивченні курсу органічної хімії, можна розташувати в ряд:
![]()
NO2 > -C≡N > -SO3H > -F > -Cl > -Br > -C≡CH > > -CH2═CH2 > -H
Якщо з атомом вуглецю з`єднаний замісник Y, що має меншу електронегативність, ніж вуглець, то його дія на молекулу буде протилежною. В цьому випадку говорять про позитивний індукційний ефект замісника Y (+І-ефект). Таким чином, знак індукційного ефекту визначається знаком заряду, який набуває замісник, що створює цей ефект. Індукційний ефект атома водню прийнятий за нуль і відносно нього визначають індукційні ефекти іншіх замісників, хоча в дійсності зв`язок С−Н має дипольний момент 0,3 D, тобто є слабо полярним.
Замісники, які проявляють +І-ефект
До замісників з +І-ефектом відносять менш електронегативні елементи, ніж вуглець (це в першу чергу лужні метали), групи атомів з повним негативним зарядом на атомі, сполученому безпосередньо з вуглецем. Причому +І-ефект тим більший, чим лівіше і нижче стоять елементи в періодичній таблиці (тобто навпаки щодо (-І)-ефекту).
Для алкільних угрупувань електронодонорні властивості залежать від їхньої структури. Прояв +І-ефекту алкільних замісників зменшується в ряді: первинний – вторинний – третинний:
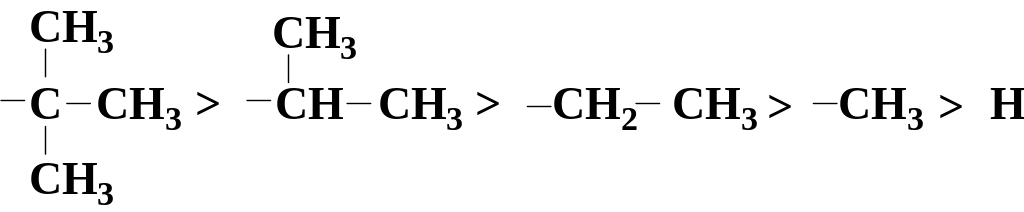
Індукційний ефект позначається стрілкою, напрямленою вздовж ординарного зв`язку в бік зміщення електронної густини. Слід, однак, зауважити, що І–ефект досить скоро згасає з відстанню і біля четвертого атома вуглецю вже майже не помітний.
