
- •2.2. Природа хімічних зв’язків
- •2.3. Ковалентні зв’язки атомІв вуглецю
- •Між атомами вуглецю
- •2.4. Квантово-механічний опис молекул
- •Метод валентних зв’язків (вз)
- •Метод молекулярних орбіталей (мо)
- •2.5. Теорія взаємного впливу атомів у молекулах органічних речовин
- •Індукційний ефект
- •Мезомерний ефект (ефект спряження, резонансний ефект)
- •Ефект надспряження (гіперкон’югації)
РОЗДІЛ 2
Сучасні ТЕОРЕТИЧНі УЯВЛЕНня В
ОРГАНІЧНІЙ ХІМІЇ
2.1. ОСНОВНІ ВІДОМОСТІ ПРО БУДОВУ ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ
Атом складається з ядра та електронної оболонки. Ядро знаходиться в центрі атома і має позитивний заряд, що дорівнює порядковому номеру елемента в Періодичний системі. Діаметр атома становить 10-9 – 10-10 м, тоді, як діаметр ядра всього 10-14 – 10-15 м. Отже, діаметр ядра приблизно в сто тисяч разів менший за діаметр атома. Однак, майже вся маса атома (99,99 %) зосереджена саме в його ядрі.
Електронна оболонка складається з електронів, що рухаються навколо ядра. Електрон є елементарною частинкою, що несе цілий елементарний негативний заряд (1,6·10-19 Кл). Кількість електронів відповідає величині позитивного заряду ядра, а значить і порядковому номеру елемента в Періодичний системі. Електрони характеризуються дуже низькою масою, тому втрата або приєднання атомом одного або навіть декількох електронів практично не змінює його маси.
Характер хімічної взаємодії між атомами, а також природа хімічного зв’язку між ними у значній мірі залежать від будови електронних оболонок атомів. Згідно з квантово-механічною теорією, електрон має подвійну природу (дуалістичність): йому притаманні властивості як електромагнітної хвилі, так і матеріальної частинки.
Електрон рухається навколо ядра зі швидкістю, що наближається до швидкості світла, створюючи, т.з. електронну хмару. Тому визначити точне положення електрона відносно ядра неможливо. Можна лише визначити ймовірність його знаходження в тій чи іншій точці простору (“принцип невизначеності В.Гейзенберга”). Та частина простору, де ймовірність знаходження електрона становить 90% називається електронною орбіталлю або атомною орбіталлю (АО). Кожна орбіталь характеризується певними розмірами та формою, а кожен електрон — певним запасом енергії, причому, чим далі від ядра знаходиться електрон, тим більша його енергія.
Математично кожна АО описується хвильовою функцією Ψ (псi), яка у фiзичному розумiннi є коренем квадратним вiд ймовiрностi знаходження електрона у певній точці простору з координатами X,Y,Z, (початок координат співпадає з ядром атома).
Електрони в багатоелектронних атомах розташовуються на т.з. “стаціонарних енергетичних рівнях”, де вони можуть рухатися навколо ядра, як завгодно довго, не витрачаючи своєї енергії. В межах одного рівня електрони розподіляються по підрівнях. Підрівні також характеризуються різною енергією, але ця різниця є значно меншою, ніж різниця енергії між стаціонарними енергетичними рівнями.
Кожен електрон в атомі характеризується чотирма квантовими числами: n, ℓ, m, s (ен, ель, ем, ес).
n - головне квантове число, визначає енергетичний рiвень, на якому знаходиться даний електрон. Характеризує середню вiддаль електрона вiд ядра, а значить розмiри електронної хмари. Крім того, n визначає енергiю електрона в атомі. Чим бiльше n, тим бiльша енергія. Головне квантове число може приймати позитивні цiлочисельнi значення. Максимальне значення n відповідає номеру періода, в якому елемент стоїть в періодичній системі.
ℓ- орбітальне квантове число, показує підрівень, на якому знаходиться електрон і визначає форму електронної орбiталi. Орбітальне квантове число може набувати цiлочисельних значень в межах вiд 0 до (n-1). Хiмiки рiдко використовують числовi значення ℓ, а застосовують його умовні позначення (s, p, d, f).
Значення головного квантового числа (n) |
1 |
2 |
3 |
Значення орбітального квантового числа (ℓ) |
0 |
0, 1 |
0, 1, 2 |
Умовні позначення орбітального квантового числа |
(s) |
(s), (p) |
(s), (p), (d) |
m -магнітне квантове число, яке показує орієнтацію електронних орбiталей у просторi i може приймати цiлочисельнi значення вiд –ℓ до +ℓ, включаючи 0.
Значення орбітального квантового числа (ℓ) |
0 (s) |
1 (p) |
2 (d) |
Значення магнітного квантового числа (m) |
0 |
–1; 0; +1 |
–2; –1; 0; +1; +2 |
Кількість можливих значень магнітного квантового числа для даного підрівня визначає кількість атомних орбіталей на ньому. Так, на s-підрівні будь-якого енергетичного рівня є тільки одна орбіталь зі значенням магнітного квантового числа нуль. На p-підрівні – три орбіталі зі значеннями магнітного квантового числа (–1); 0; (+1), а на d-підрівні – п’ять орбіталей.
s - спінове квантове число, характеризує спосiб обертання електрона навколо своєї осі та може приймати два значення: (+1/2) i (–1/2). Часто спін електрона зображають стрілкою або . Спіни електронів, напрямлені в один бік, називаються паралельними () , (), а в протилежні – антипаралельними ().
Числа n, ℓ, m разом взятi описують певну атомну орбiталь. Не слiд орбiталям приписувати реальний фiзичний змiст, як геометричних контурiв, на поверхнi яких знаходяться електрони. У дiйсностi рух електронiв в атомі достатньо складний і описується за допомогою методів теорії ймовірностей рiвнянням Е.Шредiнгера. Точний розв`язок цього рiвняння можливий для простих систем, таких як атом та анiон водню, або атом гелію. Для складніших атомів або молекул розв`язати рiвняння Шредiнгера поки що неможливо.
Згідно з “Принципом заборони” Паулі кожен електрон в атомі характеризується своїм певним значенням чотирьох квантових чисел i в атомi не може бути хоча б двох електронiв, якi б мали однаковi їх значення. Звiдси витiкає, що на однiй орбiталi може знаходитись не бiльше ніж два електрони, спiни яких протилежнi, а кiлькiсть орбiталей на рiвнi залежить вiд можливих значень ℓ та m і визначається кількістю значень m для кожного підрівня.
Таблиця 2.1.
Розподіл електронiв по атомних орбіталях
Значення квантових чисел |
Максимальне число електронів |
||||
n (енергетичний рівень) |
ℓ (енергетичний підрівень) |
m |
s |
на підрівні |
на рівні |
1 |
0 (s) |
0 |
+1/2,-1/2 |
2 |
2 |
2 |
0 (s) 1 (p) |
0 -1 0 +1 |
+1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 |
2 6 |
8 |
3 |
0 (s) 1 (p)
2 (d)
|
0 -1 0 +1
-2 -1 0 +1 +2 |
+1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2
+1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 +1/2,-1/2 |
2 6
10
|
18
|
Схематично атомну орбіталь позначають так:
|
або
|
|
або
|
|
або
|
Вакантна орбіталь Орбіталь з одним електроном Заповнена орбіталь
Н

На другому, третьому i вищих рiвнях iснують три p-орбiталi (ℓ=1; m = -1, 0, +1), якi мають форму об’ємної вісімки і розташованi у просторi взаємно перпендикулярно, вздовж трьох координатних осей.

На третьому та бiльш високих рiвнях з`являються п’ять d-орбiталей, (m = -2, -1, 0, +1, +2) форма яких ще складніша.
Отже, на першому рівні може розташуватися не більше, як 2 електрони, на другому - 8, на третьому – 18 (табл. 1.1).
Забудова електронами енергетичних підрівнів відбувається у порядку зростання суми головного та орбітального квантових чисел (n+ℓ), а при однаковій сумі (n+ℓ) спочатку заповнюється орбіталь з меншим значенням n (правило Клечковського). Виходячи з цього, послідовність заповнення енергетичних підрівнів буде наступною:
1s 2s 2p 3s 3p 4s 3d 4р 5s 4d 5p 6s...
(1+2) (2+0) (2+1) (3+0) (3+1) (4+0) (3+2) (4+1) (5+0) (4+2) (5+1) (6+0)
У дужках вказані значення суми (n+ℓ). З цієї послідовності витікає, що перед тим, як забудовується d-підрівень відбувається забудова електронами s-підрівня наступного енергетичного рівня. Ця послідовність співпадає зі зростанням енергії електрона. Отже, забудова електронами енергетичних підрівнів відбувається у порядку зростання їх енергії.
В органiчнiй хiмiї розглядаються, в основному, 1s, 2s, 2p, 3s, і 3p - орбiталi.
У відповідності з правилом Гунда в межах одного підрівня електрони розподіляються так, щоб їх сумарний спін був максимальним, тобто на кожнiй орбiталi спочатку розташовується по одному електрону, причому їхні спіни будуть обов’язково паралельними
|
|
|
Рx Py Pz
i тiльки пiсля того, як на всіх орбіталях підрівня буде по одному електрону, орбіталі починають доповнюватися другим електроном, спін якого протилежний.
Розподіл електронів по рівнях та підрівнях називається електронною конфігурацією атома і схематично зображається за допомогою електронних формул, наприклад:
6С 1s2 2s2 2p2 17Cl 1s2 2s2 2p6 3s2 3p5 |
|
Властивості атома значною мірою залежать від будови зовнішнього енергетичного рівня. Електрони цього рівня здатні приймати безпосередню участь в утворенні хімічних зв’язків і тому називаються валентними електронами.
2.2. Природа хімічних зв’язків
Чому атоми утворюють один з одним хімічні зв’язки і яка природа цих зв’язків? Справа в тому, що стабільними є тільки ті енергетичні рівні, які повністю забудовані електронами. Зовнішній енергетичний рівень буде стабільним, якщо у нього забудовані s- та p-підрівні, оскільки d-підрівень забудовується електронами після забудови s-підрівня наступного енергетичного рівня і таким чином зовнішній рівень буде знову недобудованим. Отже кожний атом намагається набути стабільної електронної конфігурації свого зовнішнього енергетичного рівня - s2, p6
(крім атома водню, для якого стабільною буде конфігурація 1s2). Цього можна досягти трьома шляхами: 1) прийняти недостаючу кількість електронів на зовнішній рівень; 2) віддати всі електрони з зовнішнього рівня, тоді зовнішнім стає другий ззовні рівень, що вже забудований електронами; 3) об’єднати електрони свого зовнішнього рівня з електронами іншого атома. При реалізації перших двох шляхів, між атомами утворюються іонні зв’язки, а при реалізації третього шляху - ковалентні.
Іонний зв’язок утворюється за рахунок сил електростатичного притягання між різнойменно зарядженими іонами. Ці іони утворюються, як правило, внаслідок переходу електронів від одного атома до іншого. Розглянемо утворення іонного зв’язку на прикладі взаємодії натрію з фтором. Атом натрію віддає фтору єдиний електрон 3s-підрівня, перетворюючись на катіон Na+ з електронною оболонкою попереднього інертного газу (Ne) .
Na - 1 e— Na+
1s2 1s2
2s2 2p6 2s2 2p6
3s1
Атом фтору, приймаючи цей електрон від атома натрію, перетворюється на аніон F¯ з електронною оболонкою наступного інертного газу (Ne) ,
F + 1 e— F—
1s2 1s2
2s2 2p5 2s2 2p6
причому, як Na+, так і F¯ набувають стабільної електронної конфігурації своїх енергетичних рівнів. Але тепер за законом електростатичного притягання катіони натрію притягуються до аніонів фтору, утворюючи іонний зв`язок Na+ F— .
Цей зв`язок, не напрямлений, що означає неможливість виділити конкретну пару іонів, які взаємодіють між собою, оскільки кожен катіон притягається до всіх аніонів, які його оточують і навпаки. Крім того, цей зв`язок буде не насиченим (не слід плутати з ненасичними кратними ковалентними зв’язками), тому що скільки б іонів протилежного знаку не оточили даний іон, він буде взаємодіяти зі всіма ними. Отже, у сполуках з іонним зв`язком, як правило, неможливо виділити конкретні два іони, між якими він утворився, тому іонний зв`язок є не векторною, а скалярною величиною.
Такий тип зв’язку утворюється, переважно, між активним металом і активним неметалом.
Ковалентний (неелектровалентний, гомеополярний) зв`язок виникає між двома конкретними атомами в результаті утворення спільної електронної пари, яка належить їм обом. Наприклад, зв`язок у молекулі водню утворюється внаслідок усуспільнення двох електронів, кожен з яких до утворення зв`язку належав окремому атому водню:
![]()
Ковалентний зв`язок у фтороводні (Н—F) також утворюється за рахунок одного електрона атома водню та ще одного електрона атома фтору. В результаті утворення ковалентного зв`язку атоми водню в обох випадках добудували свій єдиний (перший) енергетичний рівень. Атом фтору також довершив свій зовнішній (другий) енергетичний рівень, одержавши на нього один електрон від атома водню і набув електронної конфігурації 1s22s2 2p6. Такий зв’язок є двоелектронним та двоцентровим, тому що утворюється між двома конкретними атомами.
Якщо зв’язок утворився між атомами одного елемента, то спільна електронна пара буде в рівній мірі належати обом атомам; заряди на атомах не виникають і такий зв’язок буде неполярним.
Якщо зв’язок утворився між атомами різних елементів, то спільна електронна пара буде належати одному атому більше, ніж другому. Той атом, що буде сильніше притягати до себе спільну електронну пару набуде часткового негативного заряду (-), а інший - часткового позитивного (+). Такий зв’язок називається полярним ковалентним зв’язком. Здатність атома притягати до себе валентні електрони називається електронегативністю. Отже, полярність ковалентного зв’язку визначається різницею електронегативностей атомів, що його утворили і буде тим більшою, чим більшою буде ця різниця. Слід пам’ятати, що спільна електронна пара завжди стягнута до більш електронегативного атома. В таблиці 2.2 наведені значення електронегативності елементів, які доволі часто зустрічаються в органічних сполуках.
Таблиця 2.2.
Електронегативність деяких елементів (шкала Л.Полінга)
-
Елемент
Електронегативність
Водень (Н)
Літій (Li)
Бор (В)
Вуглець (С) (sp3)
(С) (sp2)
(С) (sp)
Азот (N)
Кисень (О)
Фтор (F)
Кремній (Si)
Фосфор (Р)
Сірка (S)
Хлор (СІ)
Бром (Br)
Йод (І)
2,1
1,0
2,0
2,5
2,75
3,2
3,0
3,5
4,0*
1,8
2,1
2,5
3,0
2,8
2,5
* Найвища електронегативність за шкалою Л. Полінга.
В залежностi вiд типу орбiталей, якi перекриваються та способу їх перекриття, розрізняють - та -ковалентні зв`язки.
Якщо обіталі перекриваються так, що місце їх перетинання знаходиться на відрізку прямої, що з’єднує ядра атомів, то такий зв’язок називається -зв’язком, наприклад
![]()
-(s-s) зв’язок -(s-p) зв’язок -(p-p) зв’язок
Такий спосіб перекриття орбіталей є найбільш вигідним, тому першим зв`язком, який утворюється між атомами, завжди буває саме -зв’язок .
При боковому (латеральному) перекриванні атомних p- або d-орбіталей поза лінією, що зв’язує ядра, утворюється -зв’язок:
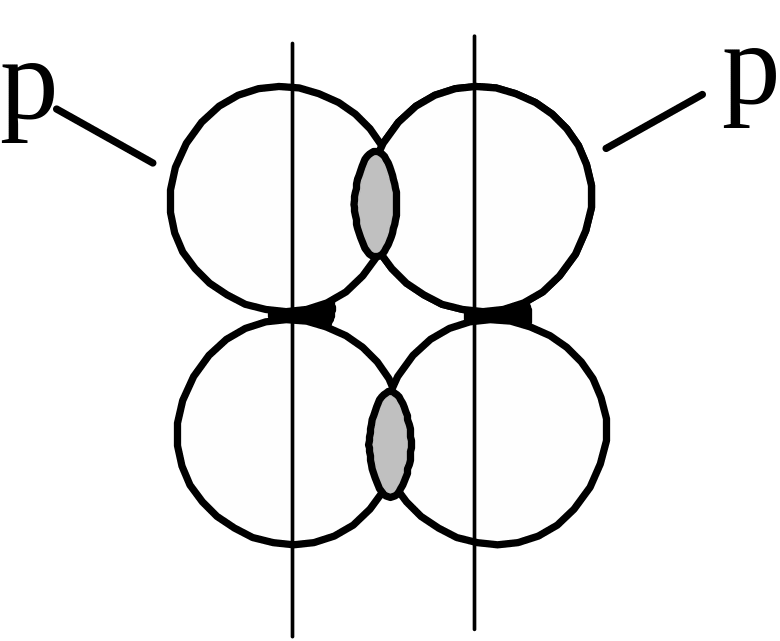
Такий тип зв’язку є менш енергетично вигідний, ніж -зв’язок, тому -зв’язок утворюється лише після того, як між атомами вже утворився -зв’язок. Отже, другий і третій ковалентні зв’язки між двома атомами бувають зв’язками -типу.
Ковалентний тип зв’язку характерний здебільшого для неметалів, оскільки в результаті утворення цього зв’язку обидва атоми добудовують свій зовнішній енергетичний рівень.
Донорно-акцепторним (координаційним або дативним) називається ковалентний зв’язок, на утворення якого один атом (донор) надає пару електронів, а другий (акцептор) — вільну атомну орбіталь. Схема утворення донорно-акцепторного зв’язку між двома атомами водню виглядає так:
![]()
За своїми властивостями донорно-акцепторний зв’язок є звичайним ковалентним зв’язком. Його відмінність від розглянутих вище ковалентних зв’язків полягає лише у способі утворення спільної електронної пари.
Інші приклади сполук з донорно-акцепторним зв’язком:
Утворення іона амонію з аміаку

Утворення оксонієвих іонів

Крім розглянутих типів зв’язків, в органічних сполуках зустрічаються водневі зв'язки.
Водневий зв'язок. При утворенні полярного ковалентного зв'язку між атомом водню та атомом з високою електронегативністю, електронна хмара атома водню сильно зміщується до цього атома. В результаті атом електронегативнішого елемента набуває значного ефективного негативного заряду, а ядро атома водню (протон) майже втрачає свій єдиний електрон. Кажуть, що атом водню протонізується. Такий протонізований атом водню буде притягатися до будь-якого іншого атома, що має надлишок електронної густини. В результаті між ними виникає електростатична взаємодія, яка зумовлює утворення водневого зв'язку. Ще однією складовою водневого зв'язку є донорно-акцепторна взаємодія, оскільки протонізований атом водню має вакантну орбіталь, а атом з надлишком електронної густини — неподілену електронну пару. У графічних формулах водневий зв'язок позначається трьома крапками.
![]()
Енергія водневого зв'язку становить 8—40 кДж/моль і за міцністю дещо перевищує енергію вандерваальсівської взаємодії, проте вона набагато менша за енергію ковалентного зв'язку. Водневий зв'язок характерний для речовин у рідкому і твердому станах. У газоподібному стані водневий зв'язок проявляється незначною мірою, оскільки відстані між молекулами дуже великі. Водневий зв'язок виявляється як у неорганічних, так і в органічних сполуках (спирти, кислоти, вуглеводи тощо).
Розрізняють міжмолекулярний і внутрішньомолекулярний водневі зв'язки.
У твердому, рідкому і навіть газоподібному станах молекули фтороводню асоційовані у ланцюги за рахунок утворення міжмолекулярного водневого зв'язку:
![]()
Асоціація молекул спричиняє аномально високі температури плавлення і кипіння фтороводню порівняно з водневими сполуками інших елементів головної підгрупи VII групи.
Між молекулами води також утворюються водневі зв’язки. Кожна молекула води може брати участь в утворенні чотирьох водневих зв'язків, в результаті кожен атом кисню зв'язується з чотирма атомами водню (з двома - ковалентними звязками, а з двома іншими – водневими):

Результатом міжмолекулярного водневого зв'язку є асоціація молекул води з утворенням ажурної просторової структури, в якій кожний атом кисню розміщений у центрі тетраедра, вершини якого займають атоми водню. Це зумовлює аномально високі температури танення льоду і кипіння води, а також високі значення теплоємності і теплоти випаровування, не зважаючи на те, що полярний ковалентний зв'язок О—Н у воді має енергію 489 кДж/моль, а водневий зв'язок між молекулами води лише 42 кДж/моль.
Взаємодія молекул, що зумовлена утворенням водневих зв'язків, не завжди приводить до утворення полімерних молекулярних агрегатів, як це має місце для НF, Н2О тощо. Іноді при асоціації утворюються димерні молекули. Наприклад, мурашина кислота існує лише у вигляді димера, який зберігається навіть у газоподібному стані:

Внутрішньомолекулярний водневий зв'язок виникає між атомами однієї молекули. Найчастіше він виявляється в молекулах органічних сполук, які містять у своєму складі групи ОН, NН2, NO2 тощо, наприклад, у о-нітрофенолі.

Водневий зв'язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворенні кристалогідратів, електролітичній дисоціації, у хімії полімерів, білків тощо.
Ще раз підкреслимо, що в органічних сполуках водневі зв`язки можуть утворювати тільки ті атоми водню, що зв`язані з киснем або азотом, тобто з атомами, що характеризуються високою електронегативністю.
Основні характеристики хімічного зв’язку:
довжина — віддаль між ядрами атомів, що утворили зв’язок; як правило, вимірюється в нанометрах (1нм = 10-9м) і дорівнює сумі ковалентних радіусів атомів, що його утворили;
енергія — робота, яку треба виконати, щоб розірвати зв’язок; або енергія, що виділяється при утворенні зв’язку з атомів, вимірюється в кДж/моль;
полярність — визначається величиною часткових зарядів на атомах, що утворили зв’язок. Вона буде тим більшою, чим більшою буде різниця електронегативностей атомів, що його утворили. Більш електронегативний атом набуде часткового негативного заряду (-), а інший - часткового позитивного (+). Якщо різниця електронегативностей менша від 1,7, то зв’язок слід розглядати як ковалентний, а якщо більша, то такий зв’язок в більшій мірі нагадує іонний, ніж ковалентний. Отже, іонний зв’язок можна розглядати, як крайній випадок поляризації полярного ковалентного зв’язку;
поляризовність – здатність зв’язку поляризуватися під дією зовнішнього електростатичного поля. Вона залежить від рухливості електронних хмар, що приймають участь в утворенні зв’язку та від способу їх перекриття. Так, -зв`язки поляризуються значно легше, ніж -зв`язки, оскільки електронна хмара -зв`язку значно рухливіша, ніж .
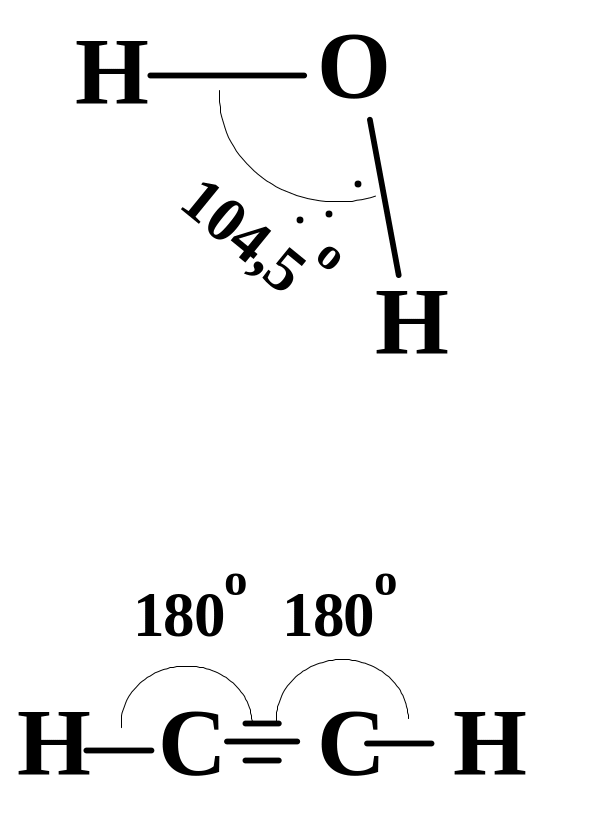
У структурних формулах ковалентний зв’язок позначається однією рискою (СС). Подвійний зв’язок, тобто комбінація - та -зв'язків — подвійною рискою (СС). Потрійний зв’язок, (комбінація - та двох -зв'язків) —трьома рисками (С С).
Прояв природи хімічного зв’язку у властивостях органічних речовин.
Сполуки з іонним зв’язком – як правило кристалічні речовини з високими температурами топлення та кипіння. Вони – сильні електроліти, добре розчиняються в полярних або іонних розчинниках. Для таких речовин характерні реакції, які супроводжуються гетеролітичним розривом хімічного зв’язку з утворенням катіона та аніона. До них відносяться солі, нітросполуки, деякі елементоорганічні речовини.
Сполуки з неполярними або малополярними ковалентними зв’язками, навпаки, характеризуються невисокими температурами топлення та кипіння. Це пов’язано зі значно слабшою міжмолекулярною взаємодією, ніж у сполук з іонним зв’язком. Такі речовини погано розчиняються в полярних розчинниках, але добре в неполярних. Для них характерні реакції, підчас яких відбувається гомолітичний розрив хімічних зв’язків з утворенням вільних радикалів – частинок з неспареним електроном. Прикладом сполук з неполярними ковалентними зв`язками можуть слугувати різні вуглеводні.
Наявність водневих зв’язків також проявляється у властивостях речовин. Більшість таких сполук так само добре розчиняються у воді, за рахунок утворення з її молекулами водневих зв’язків. Наприклад, ацетон не утворює міжмолекулярних водневих зв’язків, але в присутності води координується з її молекулами за рахунок водневого зв’язку, що зумовлює його розчинність у воді:
Р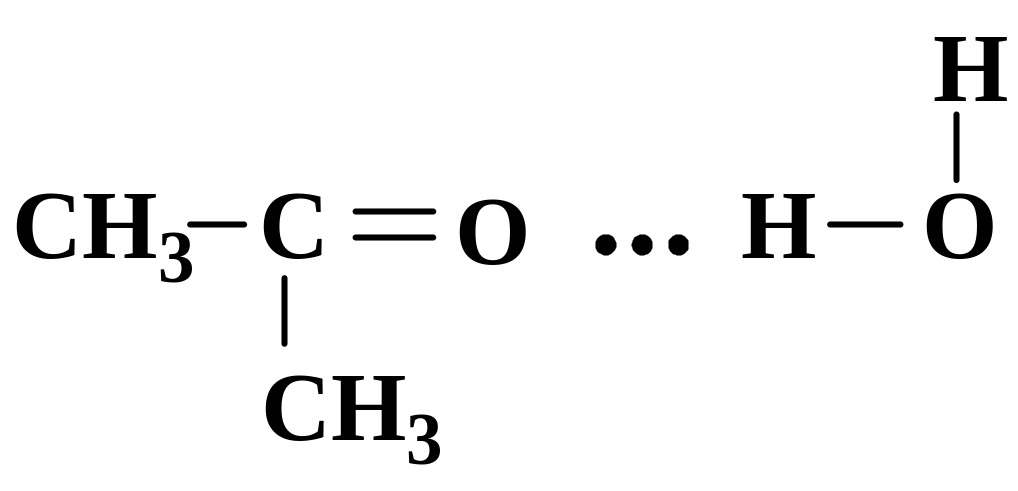 ечовини,
що утворюють міжмолекулярні водневі
зв’язки характеризуються аномально
високими температурами топлення і
кипіння. Так, вода повинна топитись і
кипіти при температурах нижчих ніж
метан, оскільки молекули води менші,
ніж молекули метану. Але за рахунок
утворення міжмолекулярних водневих
зв’язків вода має аномально високі
температури кипіння та топлення.
ечовини,
що утворюють міжмолекулярні водневі
зв’язки характеризуються аномально
високими температурами топлення і
кипіння. Так, вода повинна топитись і
кипіти при температурах нижчих ніж
метан, оскільки молекули води менші,
ніж молекули метану. Але за рахунок
утворення міжмолекулярних водневих
зв’язків вода має аномально високі
температури кипіння та топлення.
СН4 (не утворює водневих зв’язків) tтопл. = -182оС, tкип. = -161оС .
Н2О (утворює водневі зв’язки) tтопл. = 0 оС, tкип. = 100оС.

