
- •Національний медичний університет імені о.О. Богомольця
- •Методична розробка
- •Для ведення практичного заняття із студентами
- •Клінічна імунологія та алергологія
- •I Актуальність теми:
- •Іі. Навчальні цілі заняття.
- •1. Оцінка стану органів імунітету. На користь імунозалежного стану (ізс) свідчать:
- •2. Оцінка стану харчування. На користь від свідчать:
- •3. Ознаки ендокринопатії.
- •Неспецифічні мітогени лімфоцитів
- •Імуноглобуліни
1. Оцінка стану органів імунітету. На користь імунозалежного стану (ізс) свідчать:
• status thymico-lymphaticus;
• гіперплазія (або виражена гіпоплазія) лімфатичних вузлів;
•впливу на органи імунної системи (тімектомія, тонзилектомія, спленектомія, апендектомія, лімфаденектомія, рентгенівське опромінення кісткового мозку, лімфоферез та інші еферентні методи).
2. Оцінка стану харчування. На користь від свідчать:
• ознаки трофічної недостатності (фізичний маразм, квашиоркор);
• ожиріння.
3. Ознаки ендокринопатії.
4. Наявність захворювань - маркерів ВІД (різні види рецидивуючих герпетичних інфекцій, мікози, стрепто-і стафілодермія, екзема, контагіозний молюск, бородавки, гострокінцеві кондиломи та інші види пухлинних захворювань, аутоімунні та алергічні захворювання, дисбактеріози, рецидивуючі опортуністичні інфекції внутрішніх органів та ін).
Збільшення лімфатичних вузлів і селезінки
Лімфатичні вузли і селезінка складають основну частину периферичної імунної системи і збільшуються в розмірі при різних інфекціях, пухлинах, аутоімунних та метаболічних порушеннях. Збільшення лімфатичних вузлів (лімфаденопатія) і селезінки (спленомегалія) відноситься до загальних клінічних ознаками, які можуть обумовити виконання численних діагностичних і терапевтичних процедур.
Збільшення лімфатичних вузлів може бути обумовлено:
1) збільшенням числа доброякісних лімфоцитів і макрофагів в процесі імунної відповіді на антиген;
2) інфільтрацією запальними клітинами при інфекціях, при яких в процес втягуються лімфатичні вузли (лімфаденіт);
3) проліферацією in situ злоякісних лімфоцитів і макрофагів;
4) інфільтрацією вузлів метастатичними злоякісними клітинами;
5) інфільтрацією лімфатичних вузлів макрофагами, навантаженими продуктами метаболізму при хворобах накопичення ліпідів.
У нормі при імунної реакції антигенна стимуляція макрофагів і лімфоцитів в лімфатичних вузлах помітно впливає на транспорт лімфоцитів. До одного з найбільш ранніх ознак впливу антигену належить посилення кровотоку через залучений в процес лімфатичний вузол, який у період стимуляції антигеном збільшується в 10-25 разів у порівнянні з нормою. Скуплення лімфоцитів в антигенстімульованих вузлах сприяють збільшенню їх міграції через вузол, зменшенню відтоку з нього лімфоцитів і проліферації відповідних Т-і В-клітин. Лімфатичний вузол може, таким чином, в 15 разів перевищувати нормальні розміри через 5-10 днів після антигенної стимуляції.
Хвороби, що супроводжуються лімфаденопатією
У нормі у дорослих тільки пахові вузли можуть пальпуватися, а їх розміри досягають зазвичай 1,5-2 см. Необхідність в обстеженні хворого зі збільшенням лімфатичних вузлів виникає в тих випадках, коли у нього виявляються нові вузли (один або декілька) діаметром 1 см і більше та лікарю невідомо, чи пов'язана їх поява з раніше встановленою причиною.
До основних факторів, визначаючих діагностичну цінність факту збільшення лімфатичних вузлів, відносяться:
1) вік хворого;
2) фізикальні характеристики лімфатичного вузла;
3) локалізація вузла;
4) клінічний фон, асоційований з лімфаденопатією.
Зазвичай лімфаденопатія відображає процес захворювання швидше у дорослих, ніж у дітей, так як останні реагують на мінімальні стимули лімфоїдної гіперплазією. У хворих у віці до 30 років лімфаденопатія доброякісна приблизно в 80% випадків, у хворих у віці старше 50 років вона доброякісна лише в 40% випадків.
Клінічні характеристики периферичних лімфатичних вузлів відіграють особливу роль.
При лімфомі вони зазвичай рухливі, щільні, спаяні один з одним і безболісні. Вузли, залучаємо до процесу при метастазуванні карциноми, зазвичай щільні і фіксуються до прилеглої тканини.
При гострих інфекціях пальповані вузли болючі, розташовані асиметрично, спаяні, при цьому можливий розвиток гіперемії шкірних покривів.
Не менш важливі й клінічні прояви, асоційовані з лімфаденопатією. У гомосексуалістів, хворих на гемофілію, а також при тривалому внутрішньовенному введенні лікарських засобів системна лімфаденопатія інколи розглядається як СНІД (AIDS), або AIDS-подібний синдром.
Локалізація збільшених лімфатичних вузлів може виявитися важливим критерієм при діагностиці захворювань.
Задні шийні вузли часто збільшуються при інфекції волосистої частини шкіри голови, токсоплазмозі та червінці, у той час як збільшення передніх (привушних) шийних вузлів передбачає інфекцію повік і кон'юнктивальної оболонки. При лімфомі в процес можуть залучатися всі групи шийних вузлів, в тому числі задні привушні і потиличні.
Нагноєння збільшених шийних вузлів відбувається при мікобактеріальному лімфаденіті (скрофула, або туберкульозний шийний лімфаденіт).
Одностороннє збільшення шийних або нижньощелепних лімфатичних вузлів передбачає лімфому або пухлина нелімфоідної природи в області голови і шиї.
Надключичні і розташовані в області східчастого м'яза лімфатичні вузли звичайно збільшується у зв'язку з метастазуванням пухлини, локалізованої в грудній порожнині або в шлунково-кишковому тракті або у зв'язку з лімфомою.
Вузол Вірхова представляє собою збільшений зліва надключичний лімфатичний вузол, інфільтрований клітинами метастазуючої пухлини, як правило, походить з шлунково-кишкового тракту. Одностороннє збільшення епітрохлеарного вузла обумовлено інфекцією кистей рук, двостороннє його збільшення пов'язане з саркоїдозом, туляремією або вторинним сифілісом. Одностороння аксилярна аденопатія (збільшення пахових лімфатичних вузлів) може зустрітися при грудній карциномі, лімфомі, інфекції рук, хворобі котячих подряпин і бруцельозі.
Двостороннє збільшення пахових вузлів може свідчити про венеричні захворювання, проте пахова лімфогранульома (lymphogranuloma venereum) і сифіліс супроводжуються односторонньою паховою аденопатією. Прогресивне збільшення пахового лімфатичного вузла, без явних ознак інфекції передбачає злоякісну пухлину. Залучення до процесу стегнового лімфатичного вузла свідчить про лімфому.
До симптомів, які викликають підозру на розширення лімфатичних вузлів кореня легені або в області середостіння, відносяться кашель або утруднене дихання, зумовлені здавленням дихальних шляхів, рецидивуюче здавлення нерву гортані, що супроводжується охриплістю голосу, паралічем діафрагми, дисфагією із здавленням стравоходу, припухлістю шиї, обличчя або області плеча в результаті здавлення верхньої порожнистої або надключичної вени.
Двостороння аденопатія середостіння найбільш типова для лімфоми, особливо для вузлового склерозу за типом хвороби Ходжкіна. Одностороння прикоренева аденопатія вказує на високу ймовірність розвитку метастазуючої карциноми (звичайно легені), -двостороння частіше буває доброякісної і пов'язана з саркоїдозом, туберкульозом та системною грибковою інфекцією. Безсимптомна двостороння прикоренева аденопатія або пов'язана з вузлуватою еритемою або увеітом майже завжди зумовлена саркоїдозом. Зв'язок двосторонньої прикореневої аденопатії з передньою медіастинальною масою, плевральним випотом або легеневої масою передбачає новоутворення.
Збільшені заочеревинні і внутрішньоочеревинні лімфатичні вузли часто обумовлені лімфомою або іншою пухлиною. Туберкульоз може бути причиною брижового лімфаденіту з розлогим нагноєнням, а іноді і звапнінням лімфатичних вузлів.
До вірусних інфекцій, що асоціюється з системної лімфаденопатією, відносять інфекційний мононуклеоз, що викликається вірусом Епштейна - Барр. Ряд інших вірусних захворювань, включаючи вірусний гепатит, цитомегаловірусну інфекцію, краснуху і грип, може супроводжуватися клінічними синдромами, східними з обумовленими інфікуванням вірусом Епштейна - Барр. Було встановлено, що СНІД викликає ретровірус людини, Т-клітинний лімфотропний вірус людини типу III (HTLV III), так званий вірус, асоційований з лімфаденопатією (LAV). При синдромі HTLV III/LAV-асоційованої лімфаденопатії в процес втягуються групи шийних, пахвових і потиличних вузлів.
Хронічні бактеріальні та грибкові інфекції можуть викликати значне збільшення лімфатичних вузлів без ознак місцевого запалення. Хвороба котячих подряпин являє собою регіональний лімфаденіт, який розвивається через 2 тижні після пошкодження. Первинні грибкові інфекції легень (кокцідіомідомікоз, гістоплазмоз) можуть бути причиною прикореневій аденопатії. Гострі і хронічні захворювання, обумовлені мікобактеріями, паразитами і спірохетами, при яких можлива імунна реакція клітинного або гуморального типу, проявляються системним або реґіонарним збільшенням лімфатичних вузлів.
Будь-яке захворювання з імунною клітинної активацією (системний червоний вовчак, ревматоїдний артрит, сироваткова хвороба, реакція на лікарські засоби та ін.) може бути пов'язано з реґіонарною або системною аденопатією. Збільшення лімфатичного вузла при пухлини може бути викликане його залученням в пухлинний ріст, лімфоїдної гіперплазією у відповідь на пухлину або тим та іншим. Генералізована лімфоїдна гіперплазія може зустрічатися при гіпертиреозі. У хворих з хворобою накопичення ліпідів, наприклад з хворобою Гоше або Німана - Піка, також можуть збільшитися лімфатичні вузли, особливо внутрішньочеревні, що обумовлюються скупченням у них навантажених ліпідами макрофагів.
Відомий ряд захворювань неясної етіології, пов'язаних з лімфаденопатією, яка буває основним проявом багатьох з них. При саркоїдозі найчастіше збільшуються лімфатичні вузли, особливо у шийній, паховій і плечовій областях. Незважаючи на те що гігантська гіперплазія фолікулів відмічається в лімфатичних вузлах поза грудною області, в 70% випадків у процес залучаються медіастинальні і прикореневі вузли.
Клінічне обстеження хворого з лімфаденопатією
До загальноприйнятих критеріїв оцінки лімфатичних вузлів слід віднести їх величину, локалізацію, консистенцію і ступінь рухливості кожного вузла.
При обстеженні шийних вузлів лікар може знаходитися позаду або попереду сидячого хворого з тим, щоб пальпувати тканини шиї і дослідити в певній послідовності різні групи вузлів.
Вузли підборіддя розташовані по середній і боковий лініях, підщелепні вузли - ближче до кута щелепи, лімфатичні вузли шиї (яремні) знаходяться вздовж верхнього краю грудинно-ключично-соскоподібного м'яза, надключичні - позаду середній частині ключиці. Підпотиличні вузли локалізуються в області верхівки заднього шийного трикутника, а розташовані попереду вушної раковини та задньої - попереду і позаду зовнішнього вуха відповідно. Центральні пахвові вузли локалізовані біля середньої лінії грудної стінки в пахвовій ямці, бічні підпахові вузли - поблизу до верхнього відділу плечової кістки вздовж аксилярній вени, вони легше пальпуються, якщо хворий підніме руку. Підлопаткові вузли пальпуються під переднім краєм широкої м'язи спини, а грудні - нижче бічного краю великого грудного м'яза. Підключичні вузли локалізовані під дистальним кінцем ключиці, ліктьові - приблизно в 3 см від середини плечового виростка. Пальпації ліктьових вузлів сприяє перехресна пальпація цієї області в напрямку спереду назад. Збільшені внутрішньоочеревинні вузли досить складно пальпувати, це вдається в тому випадку, якщо черевна порожнина у хворого неглибока. Оцінити вузли в тазової області можна, глибоко пальпуючи нижню частину живота обертаючим рухом пальців через верхній край входу в таз.
Оцінюють лімфаденопатію відповідно до локалізації вузлів і клінічними симптомами. Збільшені надключичні вузли з'являються при лімфомі, пухлини в шлунково-кишковому тракті або в грудній порожнині, при яких слід призначати біопсію. Гострий початок шийної лімфаденопатії в осіб молодого віку при відсутності інфекції в області голови та шиї змушує думати про інфекційний мононуклеоз. При стійкому збільшенні шийних вузлів і відсутності інфекції спричиненою вірусом Епштейна - Барр чи цитомегаловірусом, токсоплазмою, при негативних шкірній пробі з PPD і даних рентгенографії грудної клітини необхідна біопсія лімфатичного вузла, щоб не пропустити лімфому, саркоїдоз, карциному та інші захворювання.
Одностороння шийна аденопатія служить підставою для дослідження ЛОР-органів на предмет виявлення злоякісного новоутворення. У безсимптомних випадках з персистуючою пахвовою і/або паховою аденопатією необхідно отримати біоптат. При лихоманці і конституціональній симптоматиці причиною може бути синдром, подібний інфекційному мононуклеозу, який слід розпізнати до проведення біопсії.
Генералізоване збільшення лімфатичних вузлів може бути наслідком системних інфекцій, прийому лікарських засобів, пухлини або одного з системних синдромів лімфаденопатії.
Історія хвороби і фізикальне обстеження можуть допомогти в діагностиці цих станів і визначенні методів клінічних досліджень (розгорнутий аналіз крові, посів крові, рентгенографія органів грудної клітини, серологічні тести, шкірні проби). При стійкій аденопатії, при якій не вдається ідентифікувати її причину, необхідно зробити біопсію лімфатичного вузла. Інформативність цього методу значна: результати біопсії дозволяють встановити діагноз в 50-60% випадків. Приблизно у 25% хворих з недіагностованими за результатами біопсії захворюваннями протягом року розвивається пухлина (зазвичай лімфома). Поряд з цим може з'явитися необхідність у повторній біопсіі, якщо симптоматика і збільшення лімфатичних вузлів персистують.
Аспіраційна (пункційна) біопсія представляє собою безпечний метод для початкової оцінки поверхневої аденопатії. Незважаючи на те що аспірація тканини лімфатичного вузла допомагає в діагностиці метастазуючою пухлини або інфекції, її рідко використовують з метою діагностики лімфоми та інших гематологічних пухлин.
Спеномегалія.
Більшість механізмів розвитку спленомегалії пов'язано з надмірним посиленням функції селезінки.
Існує цілий ряд захворювань, що супроводжуються збільшенням селезінки:
1) гіперплазія ретикулоендотеліальної або імунної системи, зокрема, при інфекціях (бактеріальний ендокардит) або захворюваннях імунної системи (синдром Фелти); гіперплазія ретикулоендотелію відбувається при захворюваннях, які супроводжуються руйнуванням аномальних еритроцитів, наприклад при спадковому сфероцитозі, таласемії або в ранньому періоді розвитку серповидноклітинної анемії,
2) зміна кровотоку в селезінці при цирозі печінки, тромбозі судин селезінки, печінки або ворітної вени;
3) злоякісні новоутворення, при яких селезінка втягується у процес первинно, наприклад, при лімфомі або ангіосаркома, або вдруге (при лейкозах і метастазах солідних пухлин),
4) стани, що призводять до екстрамедулярного гемопоезу в селезінці (мієлоїдна метаплазія або інші прояви синдрому міелофтіза),
5) інфільтрація селезінки аномальними структурами при амілоїдозі і хвороби Гоше;
6) пошкодження, що супроводжуються заповненням порожнин (гемангіома або кіста).
Спленомегалію досить часто визначають при гострих системних бактеріальних інфекціях. Інфекційні гранульоми при мікобактеріальних і грибкових інфекція утворюються і в червоній, і в білій пульпі.
При захворюваннях, таких як ревматоїдний артрит і системний червоний вовчак, спленомегалія часто буває обумовлена лімфоїдною гіперплазією на тлі збільшення лімфоїдних фолікулів білої пульпи і числа плазматичних клітин і макрофагів навколо артеріол червоної пульпи.
Ступінь спленомегалії варіює залежно від нозологічної форми.
Слабко або середнього ступеня збільшення селезінки зустрічається при хронічному застої в печінці, зумовленої застійної серцевої недостатністю, при гострій малярії, тифозної лихоманці, бактеріальному ендокардиті, системному червоному вовчаку, ревматоїдному артриті та малій таласемії.
Помірно селезінка збільшується при гепатиті, цирозі, лімфомах, інфекційному мононуклеозі, гемолітичної анемії, абсцесах і інфарктах селезінки, амілоїдозі.
Масивну спленомегалію реєструють при хронічному мієлолейкозі, ідіопатічній мієлоїдній метаплазії з мієлофіброзом, волосатоклітинному лейкозі, хворобах Гоше і Німана-Піка, саркоїдозі, великий таласемії, хронічній малярії, спадковому сифілісі, лейшманіозі та деяких випадках обструкції ворітної вени.
Діагностична оцінка хворого із спленомегалією
У нормі розміри селезінки становлять близько 12 см в довжину і 7 см в ширину і вона, як правило, не пальпується. Притуплення перкуторного звуку назовні від IX і XI міжреберних проміжків передбачає спленомегалію. Верхній лівий квадрант живота пальпують правою рукою у лежачого на спині або правому боці хворого. Лівою рукою лікар охоплює ділянку нижче грудної клітки і одночасно нижче ребер ззаду. При пальпації селезінки хворого просять глибоко вдихнути, що дозволяє лікарю відчути нижній край збільшеного органу. Для того щоб визначити масивну спленомегалію, пальпацію слід починати з нижніх відділів черевної порожнини, поступово переводячи руку в лівий верхній квадрант живота.
Поряд з пальпацією використовують сканування печінки та селезінки, комп'ютеризовану осьову томографію та ультразвукове сканування лівого верхнього квадранта. Всі ці три методи, дозволяють виявити кісту, інфаркт, пухлина селезінки або супутні порушення, зумовлені її спадковими захворюваннями, а також залишкові явища після її розриву (спленоз).
При огляді хворого із спленомегалією доцільно визначити, чи зв’язана вона з гострим або під гострим станом чи з хронічним. Гострі болі в лівому верхньому квадранті черевної порожнини з хворобливістю в області локалізації селезінки припускають субкапсулярна гематому, розрив чи інфаркт селезінки. Розрив з гематомою частіше обумовлені прямою травмою селезінки або іншими травмами, але можуть супроводжувати і інфекції, у тому числі малярію, тиф, інфікування вірусом Епштейна-Барр (інфекційний мононуклеоз). Інфаркти селезінки, зумовлені або аномалією еритроцитів in situ (при серповидно-клітинної хвороби), або емболією (при муральному тромбозі, міксомі передсердя, вегетації на клапанах серця), можна звичайно визначити за допомогою сканування або артеріографії. До нетипових гострих порушень відносяться дифузне метастазуюче ураження селезінки і геморрагічна кіста.
Гострі гарячкові стани, що асоціюються із спленомегалією, можуть бути обумовлені бактеріальним ендокардитом, синдромом інфекційного мононуклеозу, туберкульозом та гістоплазмоз. При лихоманці, периферичної аденопатії і спленомегалії з висипаннями або без них або з артралгією слід припустити, крім інфекційного мононуклеозу, саркоїдоз, хворобу Ходжкіна, хвороби сполучної тканини (колагенози), наприклад системний червоний вовчак, або сироваткову хворобу.
Гостро відбуваються захворювання, що супроводжуються спленомегалією і ознаками анемії з кровотечею або без нього, припускають аутоімунну гемолітичну анемію, мієлопроліферативних синдром або гострий лейкоз.
Застійна спленомегалія, обумовлена хворобою печінки, тромбозом ворітної або селезінкової вени, часто буває безсимптомною. При лімфаденопатії слід припустити хронічний лімфолейкоз або лімфому. Зменшення маси тіла або інші ознаки хронічного захворювання дозволяють думати про лейкозі або мієлопроліферативному синдромі, а також про гемоглобинопатію. Пункційна біопсія кісткового мозку може сприяти діагностиці лейкозу і лімфоми, хвороб накопичення, дисемінованих грибкових і мікобактеріальних інфекцій, метастазуючих пухлин і амілоїдозу.
З метою оцінки процесу спленомегалії показані лапаротомія або спленектомія. Проте вирішити питання про проведення діагностичної лапаротомії у хворого з незрозумілою спленомегалією досить складно, тому лікар повинен враховувати вік хворого, клінічну симптоматику, зміну даних лабораторних аналізів.
Гиперспленізм
Термін «гіперспленізм» застосуємо для ряду станів, при яких в селезінку надходить надмірна кількість еритроцитів, гранулоцитів і тромбоцитів із загального кровотоку.
До основних критеріїв, що дозволяє діагностувати гіперспленізм, відносяться:
1) спленомегалія;
2) руйнування в селезінці однієї або більше клітинних ліній периферичної крові;
3) не змінений кістковий мозок на тлі дефіциту клітинного складу в судинному руслі,
4) варіабельна продукція значної кількості клітин - попередників, що призводить до ретикульозу, збільшення числа паличкоядерних нейтрофілів або юних форм тромбоцитів.
Лікування при гіперспленізмі передбачає корекцію основного захворювання або патофізіологічного процесу. Якщо це завдання не розв'язне, показана спленектомія.
Гіпоспленізм
Терміни «гіпоспленія» або «аспленія» використовують для позначення дисфункції селезінки. Причини гіпоспленізма:
спленектомія,
вроджена відсутність селезінки,
серповидно-клітинна анеміа у дитини у віці старше 5 років (з явищами аутоспленектоміі, зумовленої повторними інфарктами)
опроміненням селезінки.
Після спленектомії або при функціональній аспленія у хворих відзначають схильність до бактеріальних інфекцій, часто агресивних, особливо це відноситься до інфекцій, викликаних інкапсульованими мікроорганізмами (пневмококи, нейсерії, кишкова і гемофільна палички). Тяжкість захворювання обумовлена зниженням або відсутністю фільтруючої функції селезінки, спрямованої на елімінацію опсонізованих бактерій, а також зниженням продукції антитіл, необхідних для зв'язування бактерій. Хворих з гіпоспленізмом у віці старше 2 років рекомендується імунізувати пневмококовою вакціною до проведення операції спленектомії. Зміни периферичної крові (тільця Жолли), що представляють собою прояв гіпоспленізму, на тлі нормального або збільшеного розміру селезінки припускають інфільтративне захворювання, наприклад ангіосаркому селезінки.
Показання до спленектомії
Травма селезінки,
Поетапна лапаротомія з спленектомією залишається основною діагностичною процедурою на ранній стадії лімфогранульоматоза (хвороба Ходжкіна)
Деяким хворим з ідіопатичною формою спленомегалії проводять спленектомію, однак і в цьому випадку необхідні серйозні обгрунтування.
При синдромі Фелти (ревматоїдний артрит і гіперспленізм) і хвороби Гоше спленектомія показана, якщо збільшення селезінки призводить до симптоматичної нейтропенії або інших ускладнень гіперспленізма.
Імунна тромбоцітопенічна пурпура, персистуюча на тлі медікаментозної терапії, може змінитися після спленектомії поліпшенням стану хворого. Гемолітична анемія, вроджений сфероцитоз, спадковий елліптоцітоз, імунна гемолітична анемія з тепловими реактогенними IgG-антитілами і недостатність піруваткінази можуть проявити позитивну динаміку після спленектомії.
Іноді важливим для постановки діагнозу є не самі клінічні прояви хвороби, а чутливість захворювання до певного лікування. Необхідність у тривалому використанні антибіотиків для лікування інфекції (до 2-х місяців і більше), а також потреба у їх внутрішньовенному введенні можуть свідчити на користь хвороби імунної системи.
Анамнестичні дані. Для адекватної оцінки імунного статусу необхідно з’ясувати дані щодо перебігу пологів та особливостей постнатального розвитку. Всі виявлені клінічні ознаки на момент огляду необхідно інтерпретувати в світлі зібраних анамнестичних даних. Оскільки методика збору анамнезу в імунології охоплює не всі питання щодо стану здоров’я особи, а лише забезпечує збір імунологічно орієнтованих даних, запропоновано називати такий анамнез імунологічним.
Антенатальний імунологічний анамнез включає питання:
щодо перенесених вірусних і бактеріальних захворювань матері протягом першого триместру вагітності,
щодо застосування протягом вагітності медикаментів (зокрема, препаратів глюкокортикоїдів і статевих гормонів, деяких антибіотиків, сульфаніламідів, антигістамінних і нестероїдних протизапальних засобів), які чинять імуносупресорну дію.
щодо перебування вагітної під впливом несприятливих екологічних факторів, шкідливих чинників виробництва і побуту.
Щодо загострення хронічних захворювань матері під час вагітності,
чи супроводжувалась вагітність значними стресовими навантаженнями.
При збиранні анамнезу життя дитини слід звернути увагу на факт виникнення захворювань з раннього віку, ранню появу рецидивних інфекцій: бронхолегеневих (бронхіти, пневмонії), гнійних отитів, синуїтів, діареї, екземи, фурункульозу, абсцесів, герпетичної висипки, остеомієліту, піурії нез’ясованої етіології, що може свідчити про спадковий або природжений характер ІДЗ. Цінну інформацію можуть надати дані про тяжкість та маніфестність захворювань, тривалий субфебрилітет, схильність до генералізованих процесів та реакцій, неефективність застовування традиційної терапії, що може свідчити про скомпрометованість імунної системи. До уваги слід брати розвиток аутоімунних та неопластичних захворювань, побічні реакції на вакцинацію, алергійні реакції на медикаменти і алергійні захворювання, в основі яких, без сумніву, лежать імунопатологічні процеси. Цінну інформацію про генез наявних імунних розладів можуть надати дані про тривале застосування хворим глюкокортикоїдів, цитостатиків, сульфаніламідів, антигістамінних препаратів, особливо у ранньому дитячому віці.
Генеалогічні дані. За рахунок генеалогічних даних можна з’ясувати спадковий характер наявного ІДЗ або спадкову схильність до розвитку захворювань імунної системи. Схема генеалогічного дерева, яка застосовується в клінічній імунології, відрізняється від класичної, що використовується в генетиці. Імунологічне дерево має скринінговий характер і з’ясовує не характер спадкування певної патології, а факт наявності у родичів пробанда в кількох найближчих поколіннях певних станів і хвороб, в основі розвитку яких провідну роль відіграють імунологічні розлади (рис. 1).
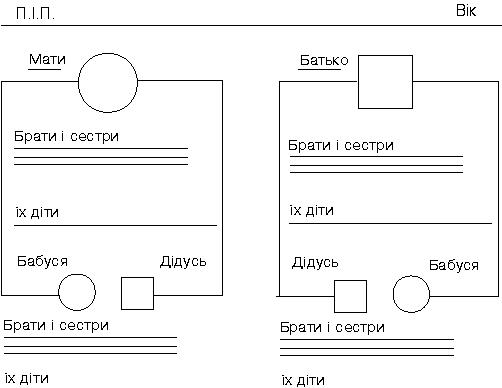
Рис 1. Родовід обстежуваної дитини. Стан здоров’я батьків.
Імунологічний анамнез. Часті інфекційні захворювання у дитинстві, часті випадки ГРВІ останнім часом; факт видалення аденоїдів, мигдаликів, апендикса; наявність хронічного тонзиліту і гаймориту, респіраторних захворювань (бронхіти, пневмонії, бронхоектази), серцево-судинних захворювань (ІХС, артеріальна гіпертензія, міокардит, ревматизм), психічних захворювань, захворювань органів травлення (гастрит, виразка, холецистит, ЖКХ, панкреатит, гепатит); захворювань нирок (пієлонефрит, СКХ, гломерулонефрит), патології системи крові (анемії, геморагічний синдром); ендокринопатій (цукровий діабет, патологія щитовидної залози), туберкульозу, мігрені; наявність онкологічних захворювань, патології статевої сфери, автоімунних хвороб, шкідливих звичок (паління, алкоголізм) та шкідливостей виробництва; випадки мертвонародження або смерті дитини у ранньому віці.
Алергологічний анамнез. Наявність алергічних захворювань: дерматит, екзема, бронхіальна астма, поліноз, кропивниця, набряк Квінке, харчова алергія; побічні реакції на певні ліки, харчові інгредієнти та побутові речовини.
Лабораторні дані. При проведенні загального аналізу крові про наявність ІДЗ може свідчити лейкопенія, лімфоцитопенія (кількість лімфоцитів менше 1,0х109/л) або немотивований лімфоцитоз, нейтропенія, тяжка гемолітична або апластична анемія, тромбоцитопенія, еозинопенія (кількість еозинофілів нижче 0,1х109/л), сповільнена ШОЕ при бактеріальних інфекціях. Із біохімічних аналізів слід звернути увагу на наявність гіпоглобулінемії, особливо за рахунок γ-фракції, до якої, як відомо, належать антитіла (імуноглобуліни). Оскільки активовані імунокомпетентні клітини і фагоцити синтезують цитокіни, що регулюють проліферацію і дозрівання клітин крові у червоному кістковому мозку (ІЛ-1β, ГМ-КСФ, М-КСФ, Г-КСФ та інші), всі хворі з лейкемоїдними реакціями мають бути проконсультовані клінічним імунологом.
Дані імунограми. Спектр імунологічних лабораторних досліджень, проведених хворому, складають його імунограму. Повноцінний клінічний аналіз імунограми може бути проведений лише в комплексі з оцінкою клінічної картини захворювання у пацієнта і даних його анамнезу. Робити клінічний висновок на підставі лише імунограми не можна, тому що одні і ті ж зміни показників імунограми можуть спостерігатися при принципово різних патологічних процесах.
Комплексний аналіз імунограми більш інформативний, ніж оцінка кожного показника окремо. Одне і те ж порушення при різних фазах гострого запального процесу може розглядатись як сприятлива і несприятлива ознака.
Реальну інформацію про зміни імунограми мають лише значні порушення показників в імунограмі (40-50% від норми і більше). В діагностичному і прогностичному плані необхідні принаймні дві імунограми в динаміці процесу.
Клінічні дані відіграють вирішальну роль, а імунограма несе допоміжне діагностичне і прогностичне значення. Відсутність зрушень в імунограмі за наявності клінічної картини патології вимагає вивчення функції компонентів окремих ланок імунної системи.
Аналіз імунограм в динаміці (особливо в співставленні з клінічною динамікою) більш інформативний з точки зору як діагностики, так і прогнозу перебігу захворювання, сприяє уникненню помилкового трактування.
Діагностичне і прогностичне значення мають індивідуальні показники норми у даного пацієнта (з урахуванням віку і наявності супровідних і хронічних захворювань, дії шкідливих факторів, медикаментозної терапії).
Першочергове значення при оцінці імунограми має співвідношення показників імунограми, а не їх абсолютні значення.
При оцінці показників імунограми слід враховувати можливість їх коливань у зв’язку з прийняттям їжі, фізичними навантаженнями, відчуттям страху, часом доби.
Невідповідність зрушень показників імунограми і клінічної картини захворювання свідчить про несприятливий розвиток запального процесу.
Чим вища антигенність чужорідного фактору і більша зона його проникнення, тим яскравішим буде запальний процес. Отже, тим значніші мають бути і зрушення в імунограмі, що буде свідчити на користь адекватності реакції імунної системи. Відсутність вказаних змін лейкограми і імунограми – несприятливий симптом, який свідчить про неадекватність роботи імунної системи. Своєчасне розпізнавання ознак такої невідповідності є головним завданням клініциста-імунолога.
Показники імунограми розподіляють на певні групи залежно від того, яку ланку імунітету вони характеризують.
Систему природженої резистентності характеризують фагоцитарне число і фагоцитарний індекс, НСТ-тест, сироватковий титр комплементу, рівень окремих компонентів комплементу, рівень лізоциму у секретах.
Клітинну ланку імунітету характеризують вміст CD3+Т-лімфоцитів (лф), CD4+ Т-лф(Т-хелперів), CD8+ Т-лф (Т-кілерів, або цитотоксичних Т-лф), CD16+ клітин (природних кілерів NK- клітин). Слід зазначити, що визначення рівня субпопуляцій лімфоцитів методом проточної цитофлуометрії за допомогою моноклональних антитіл (за CD-маркерами) надає кількісну інформацію, однак важливим є не тільки наявність тих чи інших клітин, а якість виконання ними своїх функцій.
Для оцінки функціональної здатності лімфоцитів визначають кількість клітин, що експресують адгезійні молекули (зокрема, ІСАМ-1, або СD54). Крім того, можливе вимірювання рівнів лімфоцитів за методом розеткоутворення (Е-РУК), за яким визначаються переважно активовані, залучені до імунної відповіді клітини. Функціональну характеристику надають також дослідження рівнів тих чи інших цитокінів (медіаторів імунної відповіді) у плазмі крові.
Гуморальну ланку імунітету характеризують рівні CD19+, CD20+, CD21+, CD22+ клітин (В-лімфоцитів на різних етапах диференціювання), рівні імуноглобулінів різних класів (IgM, IgG, IgA, IgE). Одним із механізмів формування імунного дефекту є патологічний апоптоз імунокомпетентних клітин. Для виявлення підвищеної готовності лімфоцитів до апоптозу (стану, що передує запрограмованій загибелі імуноцитів) проводять визначення рівнів клітин, що експресують рецептори до апоптозу (зокрема, рецептор Fas, або CD95).
Усі методи імунодіагностики поділені на тести І та ІІ рівня. Тести І рівня направлені на діагностику грубих порушень іммуної системи, тобто первинних імунодефіцитів; тести ІІ рівня – на поглибленне вивчення функціонального стану Т- та В- лімфоцитів.
Імунодіагностика порушення фагоцитозу:
Фагоцитоз – комплекс клітинних реакцій, спрямованних на розпізнання, поглинання та виведення із організму корпускулярних частин розміром більш ніж 0,5 мкм.
В процессі фагоцитозу виділяють декілька етапів:
Хемотаксис – індуцирована хемоатрактантами міграція нейтрофілів та моноцитів у вогнище запалення.
Адгезія – злипання мікробів з нейтрофілами за допомогою ліганд – рецепторів.
Поглинання мікроба – функціонування актиноміозинового цитоскелету приводить до утворення фагосоми.
Дегрануляція (викид мікробоцидного вмісту) азурофільних та специфічних гранул в фагосому з утворенням фаголізосоми.
Кисневий вибух – синтез мікробоцидних форм кисню та азоту.
Загибель мікроба в фаголізосомі під впливом кисневозалежних та кисневонезалежних механізмів.
Деградація мікробів лізосомальними гідролазами.
Екзоцитоз специфічних гранул та секреторних везикул – відтворення зруйнованої мембрани нейтрофілів та викид в оточуюче середовище речовин, котрі можуть пошкоджувати органи та тканини хазяїна.
Апоптоз нейтрофілів та видалення їх макрофагами – це важливий елемент захисту тканин та органів хазяїна від пошкоджуючої дії лізосомальних ферментів фагоцитів.
Оцінка кожної з цих стадій має певне значення в ідентифікації поламок, що виникають в наслідок спадкових або набутих дефектів фагоцитарного процесу.
Імунодіагностику порушень фагоцитарного процесу проводять перед усім по клінічним показанням при наявності ознак первинних або вторинних імунодефіцитних станів.
Оцінка хемотаксису лейкоцитів:
Спрямованний рух лейкоцитів у напрямку стимулюючого агента (хемоаттрактанта) називається хемотаксисом. До хемоатракттантів відносяться цитокіни (хемокіни, прозапальні цитокіни), фактори плазми (похідні комплементу, згортання, фібринолізу та кініноутворення, фрагменти комплементу С3а та С5а), фактор активації тромбоцитів, єйказаноїди, продукти деградації коллагена, ламініна та інших білків, мікробні продукти.
Дія хемоаттрактантів на рух клітин може відбуватися двома шляхами:
Зміна швидкості руху вне залежності від його напрямку (хемокінез)
Зміна швидкості руху по градієнту концентрації фактора (хемотаксис)
Визначення хемотаксису не отримало широкого розповсюдження в клінічній практиці. Головна причина – відсутність простих та доступних методів візначення цього виду руху.
Оцінка адгезивних властивостей фагоцитів:
За адгезивні властивості фагоцитів (нейтрофілів та моноцитів) відповідають їх поверхневі рецептори, що називаються селектинами та інтегринами. Для визначення адгезивних властивостей фагоцитів використовують декілька підходів.
При наявності відповідного обладнання найбільш простим способом є визначення молекул за допомогою моноклональних антитіл (МАТ) методом проточної цитометрії (ПЦ). За відсутністю відповідного обладнання можна використовувати МАТ у реакції непрямої імунофлюорисценції з використанням люмінесцентного мікроскопу.
Для визначення функціональної активності адгезивних молекул фагоцитів в лабораторній практиці широко використовують оцінку їх властивостей прикріплюватися до пластику, скла, культури епітеліальних клітин. В останньому випадку фагоцитарні клітини мітять радіоактивною речовиною, інкубують з епітеліальними клітинами, видаляють фагоцити, що не прикріпилися та визначають рівень радіоактивності епітеліальних клітин.
Розроблен простий спектрофотометричний метод визначення здатності фагоцитуючих клітин прикріплюватися до пластику. Суть його полягає в забарвленні за Романовським – Гімзе монослою клітин, що прилипли до пластикових лунок, екстракції барвника та визначення оптичної густини цього барвника. Виявлено наявність лінійної залежності між кількістю клітин, що прилипли та оптичною густиною.
Зміна адгезивних властивостей фагоцитуючих клітин веде до їх нездатності мігрувати в зону проникнення патогенного агенту. В наслідок таких порушень розвиваються тяжкі гнійни рецидивуючи інфекції.
Визначення фагоцитарного індексу та фагоцитарного числа:
Найбільш рзповсюджена схема постановки реакції фагоцитоза полягає у тому, що лейкоцити, виділені із периферичної крові, змішують з суспензією часток, які використовують для фагоцитозу, і інкубірують протягом 30-60'. Після цього готують препарати, і у фіксованих та фарбованих мазках підраховують фагоцитарний індекс (відсоток фагоцитуючих клітин) та фагоцитарне число (середня кількість часток, поглинутих одним фагоцитом).
На данний момент широко застосовується метод флюорисцентної мікроскопії, він є більш точним, швидким та об’єктивним.
Оцінка фагоцитарного індексу має значення при комплексній діагностиці як первинних так і вторинних іммунодефіцитних станів.
Визначення утворення активних форм кисню:
Поглинання лейкоцитами корпускулярних часточок супроводжується утворенням активних форм кисню (АФК).
Існує декілька підходів для визначення інтенсивності утворення АФК
НСТ – тест
ПЦ
Хемілюмінісценція
НСТ – тест
Даний тест характеризує окислювально-відновлювальний потенціал нейтрофілів. У основі реакції лежить відновлення у цитоплазмі нейтрофілів нітросинього тетразолію до дифармозину під впливом супероксидного аніона, який у підвищеній кількості утворюється при активізації клітини. При змішуванні краплі крові із розчином нітросинього тетразолію останній шляхом піноцитозу потрапляє до нейтрофілів, накопичується у фагоцитарних вакуолях і після активації нейтрофілів (латексом, зимозаном або пірогеналом) розчинний безбарвний НСТ перетворюється у нерозчинний темносиній формазан, який легко ідентифікувати у нейтрофілах візуально.
Підвищення інтенсивності утворення АФК відбувається при бактериіальній інфекції , що дозволяє дифференціювати їх від гострих вірусних інфекцій, а також при деяких аутоіммуних процесах (РА, НВК), при алергічних захворюваннях. Інтенсивність утворення АФК знижується при імунодефіцитних захворюваннях, обумовленних недостатністю фагоцитарної системи.
Визначення перетравлюючої здатності лейкоцитів:
Кінцевий етап фагоцитозу – перетравлення, відбувається за допомогою лізоциму та інших ферментів. Тобто здатність фагоцитів розщеплювати мікроорганізми залежить від стану ферментативної системи.
Використовують у скринінгових дослідженнях . Показаннями є первинні та вторинні імунодефіцити.
Методи кількісного визначення імуноглобулінів:
Принцип визначення вмісту імуноглобулінів базується на взаємодії іх з антитілами, отриманими проти них (тобто, на реакції антиген-антитіло, де у ролі антигена виступають імуноглобуліни, які визначають).
Можно виділити декілька групп:
Імунодифузія у гелі;
Імуноелектрофоретичні методи;
Фотометричні методи;
Іммноферментний аналіз;
Радіоімуний аналіз.
Метод радиальної імунодифузії у гелі
Метод був запроновані Манчіні (Manchini та інші, 1964) і є найбільш розповсюдженим у клініці завдяки простоті та надійності.
Суть методу. На планшет рівномірно наносять гель агару (агарози), до якого додані антитіла до імуноглобулінів відповідного класу (анти-Ig). Після затвердіння у гелі вирізають лунки, які заповнюють досліджуваною біологічною рідиною (наприклад, сироваткою крові). Молекули антигену (у нашому випадку, Ig відповідного класу) радіальне дифундують із лунки і, зустрівшись із антитілами, утворюють коло преципітації. Площа утвореного преципітату прямо пропорційна логарифму концентрації імуноглобулінів у досліджуваній рідині
При постановці реакції використовують декілька стандартів з відомою концентрацією антигену. Шляхом побудови калібрувальної кривої або математичного обчислення визначають кількість антигена у зразках.
Визначення кількості імуноглобулінів важливе при діагностичному та клінічному моніторингу первинних імунодефіцитів, моноклональних гаммапатій, аутоіммуних захворюваннях та інших патологіях.
Середній вміст імуноглобулінів для різних вікових груп:
Вікові групи |
Кількість іммуноглобулінів |
|||||||
Ig G |
Ig A |
Ig M |
||||||
Середнє значення |
коливання |
Середнє значення |
коливання |
Середнє значення |
коливання |
|||
До 1 року |
60 |
33-109 |
36 |
14-80 |
84 |
47-154 |
||
1-3 р. |
95 |
62-143 |
68 |
33-143 |
99 |
55-180 |
||
3-7р. |
109 |
70-168 |
108 |
58-201 |
106 |
64-176 |
||
7-16р. |
111 |
72-172 |
160 |
80-319 |
103 |
63-172 |
||
20-35 р |
129 |
86-195 |
214 |
128-359 |
120 |
69-206 |
||
19-60 р. |
150 |
95-235 |
110 |
55-250 |
160 |
6-405 |
||
Клінічне значення оцінки популяціонного складу лімфоцитів:
Кількісна оцінка хелперів/індукторів та цитотоксичних Т-лімфоцитів, а також визначення їх співвідношення (іммунорегуляторний індекс) важливі при дослідженні імунної системи та моніторингу пацієнтів з імунодефіцитним станом, аутоімунними захворюваннями або імуними реакціями, такими, як реакція відторгнення трансплантанту або трансплантант проти хазяїна.
Лікар повинен звертати увагу на відповідність характеру відхилення показників, що мають значення при тій чи іншій патології.
Методи, які базуються на дослідженні поверхневих маркерів лімфоцитів
На сьогодні для ідентифікації поверхневих структур лімфоцитів та низки інших клітин використовують три групи методів:
1) методи імунофлюоресценції;
2) імуноферментні методи;
3) розеткоутворення.
Методи імунофлюоресценції
Найпрогресивнішим і найточнішим методом ідентифікації поверхневих структур лімфоцитів сьогодні є метод лазерної проточної цитофлюориметрії.
Флюоресцентні методи базуються на такому феномені: молекули антитіл поєднати з молекулами флюоресцентних барвників, то їхня специфічна активність у плані приєднання до відповідних антигенів повністю зберігається.
Прямий метод імунофлюоресценції полягає у використанні анти-СD-моноклональних антитіл, до яких приєднана флюоресцентна мітка (найчастіше-ФІТЦ), який дає в ультрафіолетових променях зеленувате свічення). У таблиці наведені диференціювальні антигени лімфоцитів, які можна виявити за допомогою відповідних моноклональних антитіл. Сьогодні розроблені гібридомні технології отримання моноклональних антитіл до відповідних антигенів мембран клітин. Визначення можна проводити як у суспензії лімфоцитів, так і у цільній крові. Обов'язковим етапом є інкубація клітин з моноклональними антитілами, кон’югованими з фітохроами, зокрема ФІТЦ. Результати обраховують за допомогою проточного цитофлюориметра, який ідентифікує клітини за розмірами (популяції лімфоцитів, моноцитів, гранулоцитів), за інтенсивністю свічення (чисельність субпопуляцій, щільність рецепторів на мембранах клітин).
При відсутності у лабораторії прилада - проточного цитофлюориметра - можна для підрахунку клітин використовувати флюоресцентний мікроскоп. При спостереженні у мікроскоп клітин, оброблених міченими антитілами, можна виявити характерні зони свічення у вигляді кол (німбів), які вказують на те, що на поверхні даної клітини експресовані відповідні диференційні антигени.
Імуноферментні методи
Метод передбачає використання немічених моноклональних антитіл, які інкубують з клітинами. Візуалізація реакції здійснюється за допомогою допоміжних антитіл (наприклад, антитіла кози проти імуноголобулінів миші, якщо моноклональні антитіла були отримані на основі мишиної гібридоми). До допоміжних антитіл приєднується пероксидазна мітка, внаслідок чого при взаємодії фермент-субстрат виникає реакція, яку можна спостерігати за допомогою мікроскопу. Цей метод використовують невеликі лабораторії, які не мають дорогого обладнання.
Методи розеткоутворення
Використовуються у клінічній імунології з початку 70-х років. Методи розеткоутворення є найдешевшими серед методів кількісного визначення субпопуляцій лімфоцитів. Методи розеткоутворення засновані на феномені прилипання до поверхні клітини корпускулярних часток. Найбільш простими є методи розеткоутворення з еритроцитами тварин. Тест розеткоутворення з еритроцитами барана (Е-РУЛ) використовують для виявлення Т- лімфоцитів (доведено, що СD2 рецептори Т-лімфоцитів ідентичні Е - рецепторам і мають спорідненість до глікопротеїнів мембрани еритроцитів барана). Тест розеткоутворення з еритроцитами миші (М-РУЛ) використовують для виявлення В- лімфоцитів.
Для постановки реакції суспензію лімфоцитів інкубують з суспензією еритроцитів тварин. Після цього підраховують кількість клітин, які утворили розетки. Розеткою називають клітину, до якої прикріплені не менше, ніж три еритроцити.
При підрахунку знаходять 100 або 200 лімфоцитів і вираховують відсоток розеток серед них. Знаючи загальну кількість лімфоцитів, можна кількісно підрахувати чисельність популяцій.
Відносна кількість основних субпопуляцій лімфоцитів в крові:
Показник |
0-3 мес. |
3-12 мес. |
1-2 роки |
2-6 років |
6-16 років |
16-80 років |
CD3+ (Т-лф) |
55-78% |
45-79% |
53-81% |
62-80% |
66-76% |
55-80% |
CD4+ (Т-хелпер) |
41-64% |
36-61% |
31-54% |
35-51% |
33-41% |
31-51% |
CD8+ (Т- кілер) |
- |
- |
- |
- |
- |
19-37% |
CD3+/ CD4+ |
41-64% |
36-61% |
31-54% |
35-51% |
33-41% |
31-49% |
CD3+/ CD8+ |
16-35% |
16-34% |
16-38% |
22-38% |
27-35% |
12-30% |
CD3-/CD16+/ CD56+ (ПК) |
2-14% (1-4 м) |
2-13% (4-12м) |
3-16% |
4-23% |
4-27% |
6-20% |
CD3+/HLA-/DR+ (акт.Т-лф) |
1-9% (1-4 м) |
1-7% (4-12м) |
3-12% |
3-13% |
1-8% (6-9р) 3-14% (9-12р) 1-8% (12-16р) |
0-12% |
CD19+ (В-лф) |
19-31% |
19-31% |
19-31% |
21-28% |
12-22% |
5-19% |
CD20+ (зрілі В-лф) |
19-31% |
19-31% |
19-31% |
21-28% |
12-22% |
5-19% |
CD4+/ CD8+(ІРІ) |
- |
- |
- |
- |
- |
1,0-2,5% |
CD3+/CD4+, CD3+/ CD8+ |
- |
- |
- |
- |
- |
1,5-3,0% |
Клінічне значення визначення субпопуляції лімфоцитів:
Показник |
Підвищення показника |
Т- лімфоцити (CD3+) |
Іммунне запалення |
Т- хелпери (CD4+) |
Активний запальний процесс |
Т – кілери (CD8+) |
Активний запальний процесс при вірусній, грибковій інфекції, онкологічні хвороби |
Натуральні кілери (CD3- CD16+ CD56+) |
Гострі інфекції, активний запальний процесс, онкопроцесс |
Т-натуральні кілери (CD3+ CD16+ CD56+) |
Хронічний запальний процесс |
Активовані Т-лф (CD3+HLA-DR) |
Генералізованний гострий та активний хронічний запальний процесс |
Подвійні негативні Т-лф (CD3+ CD4+ CD8+) |
Гострий та активний хронічний запальний процесс |
В-лімфоцити, В-лф (CD19+, CD20+, CD21+, CD22+, CD72+ |
Гострий та активний хронічний запальний процесс |
Нульові лімфоцити |
Порушення гемопоезу на рівні кісткового мозку. |
Дослідження функціонального стану лімфоцитів
Оцінку кількості субпопуляцій лімфоцитів бажано доповнювати функціональними тестами. У клінічних імунологічних лабораторіях досліджують інтенсивність проліферативної відповіді лімфоцитів на мітогени Т- та В-клітин, а також синтез мононуклеарами периферичної крові низки цитокінів.
Реакція бластної трансформації лімфоцитів
Відомо, що низка речовин чинить на лімфоцити ссавців мітогенну дію і викликають їх перетворення на більш молоді, бластні форми (таблиця .).
Таблиця
