
- •Вариант 2.
- •Вариант 3.
- •Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
- •Вариант 4.
- •Реакция иодирования -фенилпропиоловой кислоты образованием , -дийодкоричной кислоты:
- •Вариант 5.
- •Реакция амина и иодистого алкила протекает по уравнению:
- •Если время полупревращения радиоактивного распада радия 1590 лет, то какова константа скорости реакции? (Распад идёт как реакция первого порядка.)
- •Реакция окисления -аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
Вариант 9.
Реакция первого порядка проходит на 25% а 35 мин, Какова величина константы скорости этой реакции в с-1? Сколько исходного вещества останется непрореагировавшим через 5 ч?
При взаимодействии персульфата калия с йодидом выделяется йод,
K2S2O8 + 2KI = 2K2SO4 + I2
При изучении кинетики этой реакции сливали равные объемы 1/15 N растворов персульфата калия и иодистого калия, Через определенные промежутки времени отбирали пробы по 25 мл раствора и оттитровывали I2 0,01N раствором тиосульфата натрия, VNa2S2O3*NNa2S2O3 = VI2*NI2 , Результаты титрования:
, мин |
9 |
16 |
32 |
50 |
V Na2S2O3, мл |
4,52 |
7,80 |
14,19 |
20,05 |
Определите константу скорости 2-го порядка,
Некоторое вещество А смешано в равных молярных количествах с веществами В и С так, что концентрации их равны 1 моль/л, По истечении 1000 с половина А прореагировала, Сколько останется вещества А по истечении 2000 с, если считать, что соответствующая реакция: а) первого порядка; б) второго порядка; в) третьего порядка,
Термическая диссоциация окиси этилена протекает по уравнению:
(СН2-СН2)О(г) CH4 + CO
При температуре 687,70С и постоянном объеме общее давление реакционной смеси, измеренное в мм,рт,ст , изменяется со временем следующим образом:
Робщ, мм рт,ст, |
116,51 |
120,56 |
125,72 |
128,74 |
133,23 |
141,37 |
, мин |
0 |
3 |
7 |
9 |
12 |
18 |
Определите порядок реакции и значение константы скорости при 687,70С
Взаимодействие трифторида бора с аммиаком изучалось по начальным скоростям при V = const при различных концентрациях реагентов:
BF3(газ) + NH3(газ) = F3B·NH3(газ)
[BF3], M |
0,250 |
0,250 |
0,200 |
0,350 |
0,175 |
[NH3], M |
0,250 |
0,125 |
0,1 |
0,1 |
0,1 |
ro, моль/(л,с) |
0,2130 |
0,1065 |
0,0682 |
0,1193 |
0,0596 |
Выведите кинетическое уравнение и определите константу скорости.
Константа скорости реакции окисления -аллилпалладиййодида под действием йода:
[-С3Н5PdI] + I2 = C3H5I + PdI2
изменяется с ростом температуры следующим образом:
t, 0C |
20 |
25 |
30 |
35 |
40 |
k2, л/(моль*с) |
1.47 |
1.80 |
2.44 |
3.06 |
4.73 |
Определите предэкспоненциальный множитель уравнения Аррениуса.
константу скорости реакции при 10оС.
Для реакции бромирования бутен-2-дисульфоната-1,4 в жидкой фазе
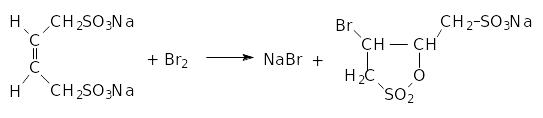
рассчитайте энтальпию и энтропию активации на основании
следующих данных:
Т, К |
293 |
298 |
303 |
k* 103, л/(мольс) |
8,9 |
11,0 |
13,7 |
Рассчитайте константу скорости реакции между йодом и водородом при температуре 5000С, если средний диаметр столкновений составляет 210-10 м, а энергия активации 167 кДж/моль. Стерический множитель равен 1.
Муравьиная кислота на окисных катализаторах разлагается в соответствии со
схемой:
HCCOH CO2 + H2 ( k1)
HCCOH CO + H2O ( k2)
В одном из опытов за 15,4 с выход С02 составил 77,5 % от теоретического, а СО - 2,6 %. Вычислите константы скоростей дегидратации и дегидрирования муравьиной кислоты.
10. Скорость реакции 2N0(г) + 2Н2(г N2(г) + 2Н20(г)
описывается кинетическим уравнением r = k*(cN0)2*cН2. Для этой реакции был предложен механизм:
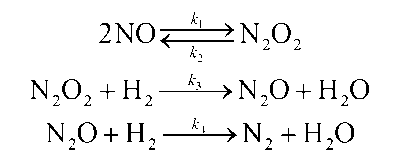
Первая и третья стадия этого процесса — быстрые химические реакции, а вторая
— медленная. Совместим ли этот механизм с экспериментальным кинетическим
уравнением?
Реакция взаимодействия катализатора Уилкинсона RhClL3, где L=P(C6H5)3, с водородом, приводящая к образованию активной формы этого катализатора RhClL2H2, способной вести процесс гидрирования алкенов, может быть описана следующей схемой:
RhClL3 RhClL2 + L k1, k-1
RhClL3 + H2 RhClL3H2 k2
RhClL2 + H2 RhClL2H2 k3
Используя метод квазистационарных концентраций для RhClL2, выведите уравнение расходования водорода. В каких условиях наблюдается первый порядок по водороду?
