
- •Вариант 2.
- •Вариант 3.
- •Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
- •Вариант 4.
- •Реакция иодирования -фенилпропиоловой кислоты образованием , -дийодкоричной кислоты:
- •Вариант 5.
- •Реакция амина и иодистого алкила протекает по уравнению:
- •Если время полупревращения радиоактивного распада радия 1590 лет, то какова константа скорости реакции? (Распад идёт как реакция первого порядка.)
- •Реакция окисления -аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
Вариант 7.
Разложение пентоксида диазота N2О5 является реакцией первого порядка, Если в системе давление N2O5 через 10 мин составляло 69,2 мм.рт.ст., а через 30 мин 39,6 мм.рт.ст, то какова константа скорости реакции?
Реакция кислотного распада бис--аллилникеля в водных растворах описывается следующим стехиометрическим уравнением:
(-С3Н5)2Ni + H3O+ = 2C3H6 + H2O + Ni2+
Начальные концентрации комплекса и кислоты соответствуют и равны 0,005 и 0,010 моль/л, Изменение концентрации H3O+ во времени при 110С характери-зуется следующими значениями:
-
Время, мин
0
20
30
40
50
60
[HCl]102, моль/л
1,000
0,3460
0,1499
0,1168
0,0957
0,0810
Подтвердите выполнимость второго порядка реакции и рассчитайте значение константы скорости,
Дитретбутилпероксид при 154,90С распадается по уравнению
(CH3)3COOC(CH3)3 2(CH3)2 С=O + C2H6
Составьте материальный баланс по каждому реагенту, определите порядок реакции и время полураспада из следующих данных по изменению общего давления в системе:
-
, мин
0
2
5
6
8
9
14
15
Робщ, мм.рт.ст
169,3
188,3
201,1
207,1
218,7
224,4
250,3
255,2
Изучалась зависимость скорости реакции димеризации бутадиена в газовой фазе от начальной концентрации бутадиена,
2 С4Н6 = С8Н12
При 240О С получены следующие данные:
Со, моль/л |
0,05 |
0,1 |
0,15 |
0,20 |
rо, 104, моль/(л,,мин,) |
0,565 |
2,26 |
5,07 |
9,02 |
Термический распад диоксана изучался при температуре 504О С, При начальном давлении диоксана 800 мм.рт.ст, его концентрация уменьшалась вдвое за 15,8 минут, а при начальном давлении 400 мм.рт.ст. _ за 22,3 мин, Определите порядок реакции и рассчитайте константу скорости реакции.
Реакция первого порядка прошла на 30% при 250С за 30 мин, а при 400С - за 5 мин. Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
По данным предыдущей задачи 6 рассчитайте Нº, Sсº(при Сo=1 моль/л ) при температуре 450С. Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
Димеризация бутадиена в газовой фазе является реакцией 2-го порядка

Эффективный диаметр молекул бутадиена равен 5,5.10-10 м. В таблице даны значения констант скорости реакции димеризации бутадиена в зависимости от температуры:
-
Т, К
503
513
527
540
578
622
k, 103, л/(мольс)
0,531
0,715
1,40
2,43
9,85
44,5
Вычислите энергию активации и опытное значение предэкспонента уравнения Аррениуса при 600 К. Рассчитайте теоретическое значение предэкспонента при 600 К по теории ТАС и сравните его с опытным значением. К какому типу (“нормальные“, “медленные“ или “быстрые“) относится рассматриваемая реакция?
Разложение оксида азота (II) при 1300 К протекает по двум параллельным реакциям:
2NO N2 +O2 (k1)
2NO N2O + 1/2O2 (k2)
Начальная концентрация оксида азота (II) равна 4 моль/л. Через 0,02 сек она изменяется на 77,85 %. Отношение концентраций N2 и N20 в любой момент времени равно 1,4. Рассчитать значения констант скоростей, считая, что этот процесс является реакцией второго порядка.
Для разложения перекиси водорода на катализаторе Pt/SiO2 В.П. Лебедев предложил следующий механизм:
2H2O2 +Pt = PtO2 +2H2O k1, k-1
PtO2 Pt +O2 k2
Константа адсорбционного равновесия первой стадии этого процесса Ка = k1/k2. Напишите кинетическое уравнение для скорости разложения H2O2 методом квазиравновесных концентраций.
Реакция разложения бромметана 2СH3Br C2H6 + Br2
протекает по следующему механизму:
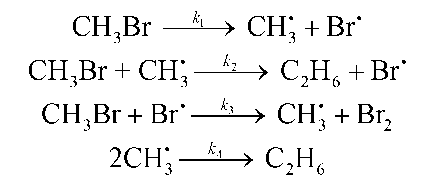
Используя метод квазистационарного приближения, найдите выражение для
скорости образования этана.
