
- •Вариант 2.
- •Вариант 3.
- •Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
- •Вариант 4.
- •Реакция иодирования -фенилпропиоловой кислоты образованием , -дийодкоричной кислоты:
- •Вариант 5.
- •Реакция амина и иодистого алкила протекает по уравнению:
- •Если время полупревращения радиоактивного распада радия 1590 лет, то какова константа скорости реакции? (Распад идёт как реакция первого порядка.)
- •Реакция окисления -аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
Варианты задач для самостоятельного решения
Варианты 1 -10
Вариант 1.
Константа скорости второго порядка для реакция нитроэтана со щелочью
СН3СН2NО2 + ОН− = Н2О + СН3СН2NО2−
имеет при 0оК k = 39,1 л/моль*мин. Был приготовлен раствор 0,004 М нитроэтана и 0,005М NаОН, Через какое время прореагирует 90% нитроэтана?
2, Реакция окисления -аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
-С3Н5PdIH2O + I2 = C3H5I + PdI2 + H2O
Начальные концентрации комплекса и йода равны 1,010-3 и 0,510-3 моль/л. За кинетикой реакции следили по изменению концентрации йода, Температура 200С, Полученные результаты приведены в таблице:
-
Время , мин
0
5
10
20
30
40
50
[I2] 103, моль/л
0,500
0,334
0,237
0,130
0,077
0,047
0,029
Определите порядок реакции и найдите среднее значение константы скорости реакции.
Изучалось гетерогенное разложение аммиака на вольфрамовой проволоке при Т = 1373 К : NН3 = 1/2N2 + 3/2 Н2
Период половины превращения (1/2) в зависимости от начального давления аммиака Ро указан в таблице:
Ро, мм рт, ст, |
265 |
130 |
58 |
35 |
1/2 , мин |
7,6 |
3,7 |
1,7 |
1,0 |
Определите порядок реакции и константу скорости,
Определите порядок реакции 2СО=СО2+СТВ при 583,20С, если в одном случае общее давление в реакции за 30 мин уменьшилось с 1,049,105 до 0,924,105 Па, а в другом за тот же промежуток времени оно уменьшилось с 0,714,105 до 0,624,105 Па (V=const),
Вычислите порядок реакции пиролиза диборана (В2Н6 (газ)) при 10оС из следующих данных по зависимости скорости реакции от концентрации диборана и найдите константу скорости,
[ B2Н6 ] ,102, моль/л ,
2,153
0,433
г,104, моль/(л,час)
7,4
0,73
Константа скорости инверсии сахарозы
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6
глюкоза фруктоза
изменяется с ростом температуры следующим образом:
t, 0C |
20 |
30 |
50 |
k 104, с-1 |
2,758 |
10,98 |
137,4 |
Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
По данным предыдущей задачи 6 рассчитайте Нº, Sсº(при Сo=1 моль/л и Сo=1 моль/см3) при температуре 1050С. Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
При изучении кинетики димеризации бутадиена получено уравнение зависимости константы скорости от температуры:
lgk = 5,062 +0,5 lgТ -5070/Т [л/(моль.с)]
Определите энергию активации и долю активных столкновений при 578 К, если стерический множитель равен 2,3*10-5.
Превращение роданида аммония в тиомочевину – обратимая реакция первого порядка: k1
NH4SCN = (NH4)2C=S
k-1
Рассчитайте константы скорости прямой и обратной реакции и константу равновесия на основании следующих данных по степени превращения NH4SCN:
-
τ, мин
0
19
38
48
60
∞
α NH4SCN, %
2,0
6,9
10,4
12,3
13,6
23,2
Определите порядок реакции распада озона, если механизм его распада можно представить схемой:
O3 + M O2 + O + M
O2 + O O3
Кинетика цепной реакции фотохимического хлорирования тетрахлорэтилена в растворе C2Cl4 описывается уравнением
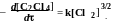
Получите приведенное выше уравнение, если реакция идет по следующей схеме:
k0
 Cl2
+ hν
2Cl·
Cl2
+ hν
2Cl·
k-1
Cl· + C2Cl4 C2Cl5·
k2
C2Cl5· + Cl2 C2Cl6+ Cl·
k3
C2Cl5· + C2Cl5· C2Cl6 + C2Cl4
Вариант 2.
Для реакции 2NO + 2 H2 = N2 +2 H2O найдено, что порядок по оксиду азота равен 2, а по водороду - первый, При 1000К константа скорости k =6·10-4 л2/(моль2·с), Чему равна скорость реакции при [NO]= 0,05 M и [Н2] = 0,01 М, Как изменится скорость, если концентрацию оксида азота утроить?
В результате реакции формальдегида с пероксидом водорода образуется муравьиная кислота. Реакция второго порядка.
НСНО + Н2О2 = НСООН + Н2О
Если смешать равные объемы молярных растворов НСНО и Н2О2, то через 2 часа при Т = 333,2 К концентрация муравьиной кислоты становится равной 0,215 моль/л, Вычислите константу скорости реакции и определите, через сколько времени прореагирует 98% исходных веществ.
3. По мере течения реакции между эквивалентными количествами окиси углерода и хлора, согласно уравнению СО + Сl2 = СОСl2 при 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
, мин |
0 |
5 |
10 |
15 |
21 |
Робщ,мм,рт, ст, |
724 |
675 |
654 |
622 |
600
|
Определите порядок реакции (V=const) графическим и аналитическим методом.
4, В реакции А + В = АВ получены следующие начальные скорости при различных начальных концентрациях реагентов:
[А]0, моль/л |
1,0 |
0,1 |
1,0 |
[В]0, моль/л |
1,0 |
1,0 |
0,0025 |
r0, моль/(л ,с)
|
0,025 |
0,0025 |
0,00025 |
Напишите кинетическое уравнение реакции? Определите константу скорости,
5, При 518оС время полупревращения реакции разложения ацетальдегида при начальном давлении 363 мм рт,ст, составляет 410 с, а при исходном давлении 169 мм рт, ст, 1/2 равно 880 с.
Определите порядок реакции и константу скорости реакции,
Реакция первого порядка имеет энергию активации 125 кДж/моль, а предэкспоненциальный множитель 5·1013 с-1. При какой температуре время полупревращения для данной реакции составит а) 1 мин; б) 30 дней?
По данным предыдущей задачи 6 рассчитайте Нº, Sсº(при Сo=1 моль/л и Сo=1 моль/см3) при температуре 1050С. Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
Рассчитайте константу скорости реакции между йодом и водородом при температуре 5000С, если средний диаметр столкновений составляет 210-10 м, а энергия активации 167 кДж/моль. Стерический множитель равен 1.
Реакцию этерификации муравьиной кислоты этиловым спиртом

 НСООН
+ С2Н5ОН
НСООС2Н5
+ Н2О
НСООН
+ С2Н5ОН
НСООС2Н5
+ Н2О
изучали в водно-спиртовом растворе соляной кислоты с начальными концентрациями [HCOOH]0 = 0.0677 M. В условиях избыточных концентраций С2Н5ОН и Н2О, как прямая так и обратная реакция подчиняются уравнениям 1-го порядка. За кинетикой реакции наблюдали по изменению концентрации HCOOH. Результаты приведены в таблице:
τ, мин |
0 |
50 |
100 |
150 |
∞ |
С HCOOH , М |
43,52 |
40,40 |
37,85 |
35,10 |
24,28 |
Определите константы скорости прямой и обратной реакций.
Экспериментально установлено, что порядок реакции разложения перекиси водорода в присутствии ионов Cr2O7-2 в зависимости от температуры изменяется от 0 до 2. Предположительно механизм этого процесса описывается схемой:
2H2O2 + Cr2O7-2 = 2H2O + Cr2O9-2 k1, k-1
Cr2O9-2 Cr2O7-2 +O2 k2
Первая стадия этого процесса протекает быстро, а вторая стадия (лимитирующая)
-медленно. Найдите кинетическое уравнение реакции и объясните изменение ее
порядка с температурой.
Реакция между пероксидом водорода и ионом Fe2+ идет по следующей схеме:
Fe2+ + H2O2 = Fe3+ + H2O + 1/2 O2
k1
Fe2+ + H2O2 FeOH2+ + HO·
k-2
Fe2+ + HO· FeOH2+,
k3
HO· + H2O2 HO2· + H2O
k4
HO2· + Fe3+ Fe2+ + H+ + O2 .
В ходе реакции образуются активные промежуточные частицы - свободные радикалы НО и НО2. Используя метод квазистационарных концентраций, по радикалу НО выведите кинетическое уравнение расходования Fe2
