
- •Вариант 1,
- •Вариант 2,
- •Вариант 3.
- •Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
- •Вариант 4.
- •Реакция иодирования -фенилпропиоловой кислоты образованием , -дийодкоричной кислоты:
- •Для реакции гидролиза метилнитрата водой:
- •Вариант 5,
- •Реакция амина и иодистого алкила протекает по уравнению:
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9,
- •Вариант 10.
Вариант 8.
В реакции второго порядка между веществами А и В начальная скорость имеет величину 7,2*10-8 моль/(л·с) при концентрации А = 0,1 моль/л и В=0,03 моль/л, Какова константа скорости реакции? Через сколько времени реакция пройдет на 10% по веществу с меньшей концентрацией?
Реакция восстановления хлорида железа(III) хлористым оловом протекает по уравнению
2 Fe+3 + Sn2+ = 2 Fe+2 + Sn4+
и подчиняется уравнению 3-его порядка, Начальные концентрации реагентов эквивалентны и равны [Fe+3]0 = [Sn2+]0 = 0,0625M, За кинетикой следили, определяя концентрации продукта [Fe+2] во времени титрованием проб бихроматом, Определите константу скорости по приведенным в таблице результатам титрования:
Время, мин |
1 |
3 |
7 |
17 |
40 |
[Fe+2], моль/л |
0,01434 |
0,02586 |
0,03612 |
0,04502 |
0,05058 |
Реакция йодирования ацетона в растворе соляной кислоты идёт по уравнению: СН3СОСН3 + I2 + Н2О = СН3СОСН2J + Н3О+ + I−
Изучалась зависимость скорости реакции от концентрации компонентов систепмы при 25О С,
Сац, ,102, моль/л |
2 |
2 |
2 |
1 |
Сйода,103, моль/л |
5 |
1,3 |
5 |
1,3 |
СHCl, моль/л |
0,1 |
0,1 |
0,025 |
0,1 |
r,106, моль/(л,мин) |
4,01 |
3,98 |
0,98 |
2 |
По приведенным данным выведите кинетическое уравнение реакции и рассчитайте константу скорости реакции,
Пользуясь зависимостью между временем полураспада и начальным давлением, определите порядок для реакции конверсии пара-водорода в орто-водород при температуре 923оК, Значения давления пара-водорода и время полураспада для пара-орто-превращения водорода p-H2 o-H2 следующие:
Ро, мм рт,ст,
50
100
200
400
1/2, с
648
450
318
222
Кинетика реакции димеризации бутадиена
2 С4Н6 = С8Н12
Определите порядок реакции и константу скорости по изменению общего давления (Робщ) в реакции при 326оС:
, мин |
0 |
8,02 |
12,18 |
33,0 |
42,50 |
68,05 |
90,05 |
259,50 |
Робщ, мм.рт.ст. |
632,0 |
599,4 |
584,2 |
527,8 |
508,8 |
474,6
|
453,3 |
381,0 |
Константа омыления уксусно-этилового эфира едким натром
H3CCOOC2H5 + NaOH = H3CCOONa + C2H5OH
при 90С k = 2,37 л/(мольмин), а при 140С – k = 3,204 л/(мольмин). При какой температуре константа скорости равна 5 л/(мольмин)?
Изопропенилаллиловый эфир в парообразном состоянии при температуре 1500С изомеризуется в аллилацетон
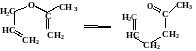
Зависимость константы скорости от температуры описывается уравнением:
k = 51011 exp (-122200/RT), c-1; [E] = Дж/моль
Рассчитайте энтальпию и энтропию активации и дайте интерпретацию последней.
Предполагается, что реакция I- + OCl- = OI−+Cl−
в растворе имеет следующий механизм:
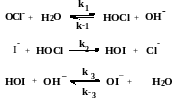
В первой и третьей реакцией быстро устанавливается равновесие, а вторая стадия является лимитирующей. Выведите кинетическое уравнение реакции, соответствующее этому механизму. Оказывает ли какое-либо вещество тормозящее влияние?
Суммарное уравнение разложения перекиси водорода при фотохимическом образовании щавелевой кислоты отвечает суммарной реакции:
![]()

Выведите кинетическое уравнение для разложения перекиси водорода.
