
- •Вариант 1,
- •Вариант 2,
- •Вариант 3.
- •Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
- •Вариант 4.
- •Реакция иодирования -фенилпропиоловой кислоты образованием , -дийодкоричной кислоты:
- •Для реакции гидролиза метилнитрата водой:
- •Вариант 5,
- •Реакция амина и иодистого алкила протекает по уравнению:
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9,
- •Вариант 10.
Вариант 6.
1. Разложение мочевины в кислой среде имеет первый порядок по мочевине в избытке кислоты и воде:
H2NCONH2 + H+ + 2H2O = 2NH4+ + HCO3−
При начальной концентрации мочевины равной 0,2 М скорость реакции составляет 8,56,10-5 моль/(л,с) при t =61ºС, Определите константу скорости, концентрацию реагента через 5000 с, а также скорость реакции в этот момент,
2, Изменение концентрации метильных радикалов 2СН3 = С2Н6
изучали с помощью флеш-фотолиза (мгновенных вспышек), Были получены следующие данные:
-
Время, мкс
0
10
20
30
40
50
[CH3∙],106, М
1,25
0,95
0,80
0,65
0,57
0,50
Определите порядок реакции и значение константы скорости,
3, Реакция разложения пентоксида диазота в газовой фазе протекает по уравнению:
N2O5 = 1/2 O2 + N2O4
Кинетику этого процесса изучали, измеряя увеличение общего давления (ΔР = Робщ,– Р0) в реагирующей системе в определенные моменты времени при V=const, При 328,1 К были получены следующие данные:
, мин |
3 |
5 |
7 |
9 |
12 |
18 |
26 |
38 |
∞ |
ΔР, мм рт,ст, |
73 |
116 |
152 |
183 |
218 |
266 |
299 |
320 |
331 |
Каков порядок реакции, среднее значение константы скорости и период полураспада?
4, Время разложения для двух различных соединений РН3 (1) и N2О (2) на 50% при различных исходных давлениях приводится ниже:
1 |
РоРН3, мм рт,ст, |
139 |
52,5 |
1/2, с |
84 |
83 |
|
2 |
РоN2O,мм рт,ст, |
79 |
37,5 |
1/2, с |
470 |
860 |
Определите порядок обеих реакций,
Для реакции разложения ацетальдегида в газовой фазе:
Н3ССНО = СН4 + СО
изучена зависимость начальной скорости от давления ацетальдегида
Рсн3сно0·10-4, Па |
0,88 |
1,08 |
1,6 |
2,93 |
3,49 |
5,05 |
r0, Па/мин |
110 |
151 |
263 |
700 |
810 |
1397 |
Определите порядок реакции и константу скорости .
Найдите энергию активации реакции и предэкспоненциальный множитель уравнения Аррениуса для реакции взаимодействия оксида углерода с диоксидом азота:
CO + NO2 = CO2 + NO
Т, К |
600 |
650 |
700 |
750 |
800 |
k, л/(моль.с) |
0,028 |
0,22 |
1,3 |
6,0 |
2,3 |
Диаметр метильного радикала равен 3,810-10 м. Какова гипотетическая максимальная константа скорости реакции второго порядка для рекомбинации радикалов при комнатной температуре. Трансмиссионный коэффициент принять равным 1, а энергию активации - 3 кДж/моль.
Для следующей схемы сложной реакции:
k1
A + С = X +D
k-1
k2
X +A → Y + C
k3
Y + D → P
где Х , Y промежуточные высокореакционные реагенты
Используя метод квазистационарных концентраций по Х и Y выведите кинети-
ческое уравнение реакции по реагенту А.
Для реакции гомогенного пиролиза этана, протекающей по следующему основному маршруту C2H6 = C2H4 + H2 , предложен следующий механизм:
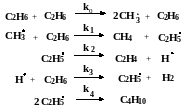
Выведите кинетическое уравнение образования этилена, используя метод квазистационарных концентраций. Каков порядок реакции по реагенту в этом уравнении? Тормозится ли реакция продуктами? Есть ли в механизме лимитирующая стадия?
