
- •Вариант 1,
- •Вариант 2,
- •Вариант 3.
- •Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
- •Вариант 4.
- •Реакция иодирования -фенилпропиоловой кислоты образованием , -дийодкоричной кислоты:
- •Для реакции гидролиза метилнитрата водой:
- •Вариант 5,
- •Реакция амина и иодистого алкила протекает по уравнению:
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9,
- •Вариант 10.
Вариант 5,
Реакция амина и иодистого алкила протекает по уравнению:
(С2Н5)3N + RI [(C2H5)3NR]+I-
[х]
Скорость реакции в нитробензоле определялась при 25оС, причем найдено, что
-
, с
1200
1800
2400
3600
4500
5400
х, моль/л
0,00876
0,01066
0,01208
0,01392
0,01476
0,01538
Начальные концентрации амина и иодистого алкила равны 0,0198 моль/л, Реакция второго порядка, Определите константу скорости,
Если время полупревращения радиоактивного распада радия 1590 лет, то какова константа скорости реакции? (Распад идёт как реакция первого порядка,)
Реакция окисления -аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
-С3Н5PdIH2O + I2 = C3H5I + PdI2 + H2O
Начальные концентрации комплекса и иода равны 1,1010-3 и 0,6510-3 моль/л, За кинетикой реакции следили по изменению концентрации йода, Температура 250С, Полученные результаты приведены в таблице:
-
Время , мин
0
5
10
20
30
40
50
[I2] 103, моль/л
0,650
0,387
0,255
0,128
0,071
0,041
0,024
Покажите, что реакция имеет первый порядок по каждому из реагентов и найдите среднее значение константы скорости реакции,
Кинетика реакции димеризации бутадиена
2 С4Н6 = С8Н12
Определите порядок реакции и константу скорости по изменению общего давления (Р) в реакции при 326оС:
, мин |
0 |
3,25 |
12,18 |
17,30 |
33,0 |
Робщ, мм, рт,ст, |
632,0 |
618,5 |
584,2 |
566,1
|
527,8 |
, мин |
42,50 |
55,08 |
90,05 |
119,00 |
259,50 |
Робщ, мм, рт,ст, |
508,8 |
490,2 |
453,3 |
432,8 |
381,0 |
Определите порядок реакции и константу скорости реакции при данной температуре.
Изучалась зависимость скорости распада диоксида азота от концентрации реагента 2NO2 = 2NO +O2
Определите вид кинетического уравнения этой реакции и рассчитайте значение константы скорости по следующим данным:
С NO2,105 , моль/л |
4,47 |
5,01 |
6,31 |
7,94 |
10 |
12,59 |
r , моль/(л,сек) |
0,032 |
0,040 |
0,063 |
0,095 |
0,158 |
0,214 |
Константа скорости разложения пентоксида диазота
N2O5 = 2 NO + O2
равна 0,07910-5с-1 при 00С и 12,910-5с-1 - при 350С. Рассчитайте энергию активации
и величину предэкспоненциального множителя.
Для реакции разложения диоксида азота 2NO2 = 2NO + O2 предэкспоненциальный множитель уравнения Аррениуса равен 3109 л/(мольс). Рассчитайте стерический фактор этой реакции, если газокинетический диаметр молекулы диоксида азота равен 3,6
 ,
а температура 500 К.
,
а температура 500 К.Для следующей схемы сложной реакции:
k1
A+D = X +2C
k-1
k2
X +C → Пр
где Х , Y промежуточные высокореакционные реагенты
Используя метод квазистационарных концентраций по Х и Y выведите кинети-
ческое уравнение реакции по реагенту С.
Реакция термического разложения азотной кислоты при 4000С описывается уравнением 2HNO3 = H2O + O2 + NO2 + NO и протекает по механизму
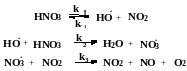
Выведите уравнение скорости расходования азотной кислоты в квазистационарном режиме. Как изменится порядок реакции по реагенту по мере увеличения степени конверсии? Какой из продуктов оказывает тормозящее действие?
