
- •Вариант 1,
- •Вариант 2,
- •Вариант 3.
- •Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
- •Вариант 4.
- •Реакция иодирования -фенилпропиоловой кислоты образованием , -дийодкоричной кислоты:
- •Для реакции гидролиза метилнитрата водой:
- •Вариант 5,
- •Реакция амина и иодистого алкила протекает по уравнению:
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9,
- •Вариант 10.
Вариант 3.
Найдено, что в реакции SO2Cl2 = SO2 + Cl2 lg[SO2Cl2] линейно убывает со временем, За 240 с концентрация реагента уменьшилась от 0,4 до 0,28 М, Каков порядок реакции и время полупревращения?
Фенилдиазохлорид разлагается по уравнению:
С6Н5N2Cl C6H5Cl +N2
В опыте, проводившемся при 323 К, измеряли объемы выделившегося азота, Были получены следующие результаты:
-
τ, мин
6
9
12
14
18
22
24
26
30
∞
VN2, см3
19,3
26,0
32,6
36,0
41,3
45,0
46,5
48,3
50,4
58,3
Определите порядок реакции и константу скорости реакции,
Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
H3CC6H4NO2 + HNO3 = H3CC6H3 (NO2)2 + H2O
При изучении зависимости начальной скорости реакции от концентра-ции реагентов были получены следующие данные:
-
Спнт,104, моль/л
5
3
2
5
СHNO3,, моль/л
0,4
0,8
0,4
0,8
r,106 , моль/(л*мин)
5
6
2
10
Определите порядок реакции по каждому реагенту и рассчитайте константу скорости реакции,
Пользуясь зависимостью между временем полураспада и давлением, определите порядок для реакции конверсии пара-водорода в орто-водород при температуре 923оК, Значения давления пара-водорода и время полураспада для пара-орто-превращения водорода следующие:
Ро, мм рт,ст,
50
100
200
400
 1/2,
с
1/2,
с648
450
318
222
Газообразный азометан разлагается по реакции первого порядка:
СН3-N=N-CH3 СН3-CH3 + N2
При температуре 2870С и начальном давлении азометана равным 160 мм.рт.ст. через 100 с общее давление достигло 161,6 мм.рт.ст. Найдите константу скорости реакции и время полупревращения при указанной температуре.
Константа скорости омыления этилацетата щелочью изменяется с ростом температуры следующим образом:
t, o C |
0 |
20 |
25 |
k, л/(мольмин) |
1,17 |
5,08 |
6,56 |
Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
Окисление оксида азота озоном являетс бимолекулярной реакцией с энергией активации 9,6 кДж/моль:
NO + O3 = NO2 + O2.
Газокинетический диаметр молекулы азота равен 3 Å а молекулы озона − 4 Å. Определите теоретическое число молекул, реагирующих в 1 м3 за 1 с при температуре 300 К и давлении 1 атм. Рассчитайте теоретическое значение предэкспонента уравнения Аррениуса для этой реакции по ТАС и сравните его с экспериментальным значением А = 1,1.109 л/(моль·с). Вычислите стерический множитель. Сделайте выводы о характере реакции на основании полученного значения стерического множителя.
Для следующей схемы сложной реакции:
k1
A = X +C
k-1
k2
X +C → Пр
где Х промежуточная высокореакционная частица
Используя метод квазистационарных концентраций по Х выведите кинети-
ческое уравнение реакции по реагенту А.
Кинетика термического распада дихлорэтана в газовой фазе описывается уравнением
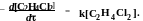
Согласуется ли вышеприведенное уравнение скорости со следующей схемой цепного механизма реакции?
k0
C2H4Cl2 C2H4Cl· + Cl·
k-1
Cl· + C2H4Cl2 C2H3Cl2· + H· ,
k2
C2H3Cl2· C2H3Cl· + Cl·
k3
C2H3Cl2· + стенка C2H3Cl2· адс.
Используя метод квазистационарных концентраций выведите кинетическое
уравнение реакции.
