
- •Строение ферментов
- •Свойства ферментов
- •Определение активности ферментов
- •6.3.2. Влияние концентрации субстрата
- •6.4. Ингибиторы ферментов
- •6.4.1. Обратимые ингибиторы
- •7.1. Общая характеристика
- •7.2. Иммобилизованные ферменты
- •7.3. Применение ферментов в медицине
- •7.3.1. Ферменты в клинической диагностике
- •7.3.2. Молекулярные основы энзимопатий
- •7.5. Применение ферментов в производственных процессах
6.4. Ингибиторы ферментов
Скорость ферментативных реакций может быть частично снижена или полностью заблокирована определенными веществами, так называемыми ингибиторами ферментов. Некоторые ингибиторы ферментов являются для организма животных и человека эффективными лекарственными веществами, другие — смертельными ядами.
6.4.1. Обратимые ингибиторы
Различают три типа обратимого ингибирования ферментов: конкурентное, неконкурентное и бесконкурентное.
Конкурентным называют ингибитор, обратимо взаимодействующий с активным центром фермента. Как правило, конкурентные ингибиторы по структуре похожи на субстрат и могут вытесняться из фермент-ингибиторного комплекса избытком субстрата. Взаимодействие с конкурентным ингибитором не приводит к денатурации или инактивации фермента, поэтому при замене ингибитора на субстрат скорость ферментативной реакции не снижается (рис. 6.10).
При взаимодействии фермента с конкурентным ингибитором изменяется значение Ки соответствующей ферментативной реакции.
Сходство субстрата и конкурентного ингибитора достаточно для взаимодействия и образования фермент-ингибиторного комплекса, но недостаточно для ферментативной реакции. В качестве примера можно привести действие малоновой кислоты на реакцию, которая катализируется сукцинатдегидроге-назой и связана с превращением янтарной кислоты в фумаровую.
![]()
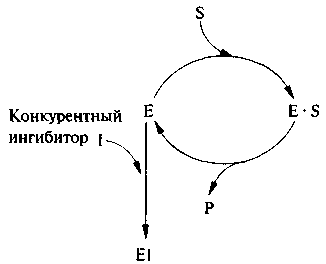
Рис. 6.10. Схема действия конкурентного ингибитора
Добавление малоновой кислоты к реакционной смеси снижает или полностью останавливает ферментативную реакцию, так как она является конкурентным ингибитором сукцинатдегидрогеназы.
![]()
Сходства малоновой кислоты с янтарной достаточно для образования комплекса с ферментом, однако распад этого комплекса не происходит. При увеличении концентрации янтарной кислоты она вытесняет малоновую кислоту из комплекса, в результате активность сукцинатдегидрогеназы восстанавливается.
Многие лекарственные вещества ингибируют ферменты человека и животных по конкурентному типу. Примером могут служить сульфамидные препараты, по структуре сходные с я-аминобензойной кислотой (ПАБК). Это соединение в микробных клетках является интермедиантом фолиевой кислоты — важного компонента нуклеинового обмена. При введении сульфамидных препаратов в организм происходит ингибирование ферментов метаболизма ПАБК, что приводит к снижению синтеза нуклеиновых кислот и гибели микроорганизма.

В данном случае сульфаниламид является конкурентным ингибитором фермента синтеза фолиевой кислоты.
В структуру пептогликана клеточной стенки бактерий включен D-аланин, отсутствующий в организме животных и человека. Для синтеза клеточной стенки бактерии при помощи фермента аланин-рацемазы превращают животный L-аланин в D-форму. Аланин-рацемаза характерна для бактерий и не обнаружена у млекопитающих. Следовательно, она представляет хорошую мишень для ингибирования лекарственными препаратами. Замещение одного из протонов метильной группы на фтор дает фтораланин, с которым связывается аланин-рацемаза, что приводит к ее ингибированию.
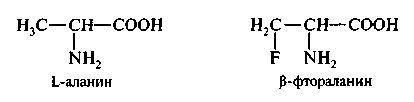
Таким образом, можно конструировать лекарственные вещества, ингиби-рующие ферменты по конкурентному типу. Чтобы быть эффективным, ингибитор должен иметь высокое сродство к ферменту. В противном случае необходимо назначать большие дозы лекарственных препаратов, чтобы активно конкурировать с эндогенным субстратом за активный центр фермента.
Неконкурентные ингибиторы взаимодействуют с ферментами не в области активного центра, а на каком-то от него удалении, причем никаким избытком субстрата из комплекса не удаляются. При взаимодействии ингибитора с ферментом происходит изменение его конформации с последующей частичной дезинтеграцией активного центра. При взаимодействии фермента с неконкурентным ингибитором изменяется Vmax ферментативной реакции.
Бесконкурентное ингибирование имеет место, когда ингибитор взаимодействует с ферментом только в составе фермент-субстратного комплекса, препятствуя его распаду. Примером необратимого действия ингибиторов на ферменты могут служить фосфорорганические вещества, применяемые в качестве инсектицидов.
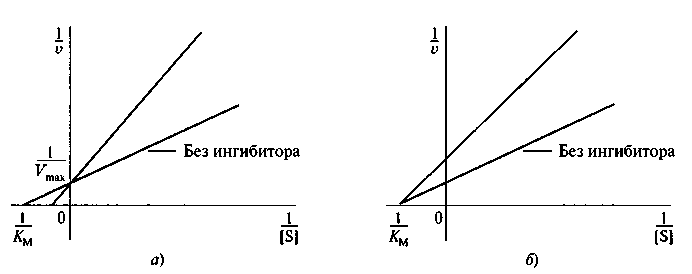
Рис. 6.11. График Лайнуивера—Бэрка для идентификации различных типов ингибирования: а — конкурентное ингибирование; б— неконкурентное ингибирование
Тип ингибирования можно определять графически, используя методы Лайнуивера—Бэрка или Эди—Хофсти (рис. 6.11).
Как видно из рис. 6.11, влияние конкурентного ингибитора на скорость реакции приводит к изменению Км, максимальная скорость реакции при этом остается без изменения. Неконкурентное ингибирование связано со снижением Vmax, без изменения константы Мехаэлиса.
Активность многих ферментов тормозится избытком субстрата, причем имеется несколько механизмов этого процесса.
Если в образовании фермент-субстратного комплекса участвует несколько функциональных групп фермента, то возможно одновременное присоединение к активному центру двух или более субстратов, что однозначно приведет к образованию неактивного комплекса.
В случае избытка субстрата возможно его присоединение не только к активному центру, но и к другим химическим группировкам, функционально связанным с активным центром. Такого рода взаимодействие может помешать ферментативной реакции.
Увеличение концентрации субстрата может повысить ионную силу реакционной среды и, как следствие, затормозить скорость ферментативной реакции.
Торможение продуктами реакции связано с тем, что они могут связываться с ферментом или с каким-либо другим компонентом системы таким образом, что скорость прямой реакции снижается.
Основы гетерогенного катализа. Липолитические ферменты
Рассмотренные выше принципы относятся к катализу, протекающему в водной фазе, так называемому гомогенному катализу. Однако в клетках или тканях организма осуществляется значительное число реакций на границе раздела фаз по механизмам гетерогенного катализа. Естественно, что в данных условиях катализ и кинетика ферментативных реакций должны отличаться от традиционной ферментативной кинетики. В условиях гетерогенного катализа субстрат, как правило, неподвижен по отношению к ферменту, который находит его в начале каталитической реакции. Это связано с локализацией субстрата в мембранах или агрегацией его в тех или иных локусах клетки. Таким образом, в первой фазе каталитической реакции субстратом является не отдельная молекула, а неводная фаза того или иного агрегата. В литературе имеется даже соответствующий термин «суперсубстрат», обозначающий матрицу, на которой иммобилизован конкретный субстрат для соответствующей ферментативной реакции. Необходимым условием последней является также ориентация фермента в пространстве таким образом, чтобы произошел контакт его активного центра с субстратом. В отличие от гомогенного катализа ферментативные реакции на границе раздела фаз зависят от степени дисперсности нерастворимой фазы (рис. 6.12).
Липолитические ферменты растворимы в воде, однако воздействуют они на гидрофобные субстраты. Таким образом, катализ осуществляется на границе раздела мицелла—вода. К липолитическим ферментам относят гидролазы эфиров жирных кислот с длинной (не менее 12 атомов углерода) цепью — липазы, фосфолипазы и холестерол-эстеразы.
Липазы гидролизуют эфирные связи в триглицеридах. Для этих ферментов свойственна стереоспецифичность, т. е. способность гидролизовать сложноэфир-ную связь или в положении 1, или в положении 3. На скорость липолиза оказывают влияние соли натрия, кальция, желчных кислот. Третичная структура липазы предусматривает наличие гидрофобного сайта, при помощи которого она соединяется с липидами, и гидрофильного хвоста, локализованного в водной фазе. Активный центр фермента находится вблизи гидрофобной головки.
Холестерол-эстеразы являются сериновыми ферментами, содержащими в активном центре сульфгидрильные группировки. Они также имеют гидрофобные участки для связи с субстратом и гидрофильные сайты, локализованные в водной фазе.
Определение кинетических констант, таких, как Км и ¥тях, для липолити-ческих ферментов представляет значительные трудности. Необходимо делать ряд допущений, связанных со спецификой данных реакций. Например, при оценке Км приходится учитывать адсорбцию фермента в суперсубстрат, в который включен субстрат на границе раздела фаз. В данном случае уравнение реакции будет выглядеть следующим образом:
![]()
где Ss — концентрация субстрата, сорбированного в липидной фазе.
Регуляция активности ферментов
Различают экстенсивную и интенсивную регуляцию активности ферментов в клетках и тканях организма. Экстенсивная регуляция обусловлена индукцией или репрессией генов, кодирующих синтез соответствующих ферментов. Увеличение или уменьшение числа активных молекул определяет суммарную активность пула данного фермента в каком-либо компартменте клетки, в ткани или целом органе. В физиологических условиях содержание того или иного фермента в клетке постоянно и регулируется двумя процессами: скоростью его синтеза и распада. Оба эти процесса взаимосвязаны и контролируются на генном уровне. Увеличение скорости синтеза ферментативного белка обусловливает активацию внутриклеточных протеиназ и ускоренный распад «старых» молекул фермента, а снижение скорости синтеза приводит к замедлению распада ферментативного белка.
Интенсивная регуляция связана с изменением активности зрелых, функционирующих молекул и определяется разнообразными молекулярными механизмами.
Аллостерические ферменты

Кривая зависимости скорости ферментативной реакции от концентрации субстрата, характерная для аллостерических ферментов
Термин аллостерический образован от греческих слов: аллос — другой и стереос — пространственный. Существует ряд ферментов, имеющих в своем составе, кроме активного центра, так называемый аллостерический центр, присоединение к которому определенных химических веществ — эффекторов — приводит к изменению конформации белковой глобулы и, как следствие, модификации ферментативной активности. Молекулы аллостерических ферментов содержат наборы как активных, так и аллостерических центров, причем с аллостерическим центром может соединяться как субстрат, так и эффектор, отличающийся по строению от субстрата В первом случае взаимодействие является гомотроп-ным, во втором — гетеротропньш. Пространственная обособленность активных и аллостерических центров обусловлена наличием четвертичной структуры, характерной для аллостерических ферментов. Аллостерические взаимодействия наиболее ярко проявляются в характере кривых зависимости скорости ферментативной реакции от концентрации субстрата. Вместо гиперболической кривой, подчиняющейся закономерностям Михаэлиса—Ментен, для аллостерических ферментов характерна сигмоидная кривая, представленная на рис. 6.13. Как видно из рисунка, при малых концентрациях субстрата скорость ферментативной реакции гораздо ниже, чем для обычных ферментов в равных условиях.
Присоединение лиганда к аллостерическому центру фермента изменяет скорость реакции, причем если скорость реакции возрастает, то такой эффектор называют положительным, если снижается — отрицательным.
Аллостерические ферменты состоят как минимум из двух идентичных субъединиц, каждая из которых имеет один активный и один регуляторный (аллостерический) центры. При взаимодействии субстрата или эффектора с ферментом происходит изменение конформации одной из субъединиц, что вызывает модификацию высших структур второй субъединицы. Конформаци-онные превращения обусловливают изменения каталитической активности молекулы фермента.
Механизм действия аллостерических ферментов имеет много общего с процессом присоединения кислорода к гемоглобину (гл. 3).
В обоих случаях присоединение лиганда приводит к изменению конформации белковых субъединиц и изменению скорости реакции.
Мультиферментные комплексы
Наиболее эффективно происходит регуляция в так называемых мульти-ферментных комплексах. Эти комплексы представляют собой несколько ферментов, катализирующих ряд согласованных реакций, причем конечные продукты одной ферментативной реакции являются исходными субстратами для следующей ферментативной реакции. Различают три типа мультиферментных комплексов:
ферменты растворены в цитоплазме и контакт субстратов с ними осуществляется посредством диффузии;
ферменты соединены друг с другом за счет белок-белковых взаимодействий;
ферменты соединены друг с другом и иммобилизованы на внутриклеточных или цитоплазматических мембранах.
В каждом мультиферментном комплексе имеется, по крайней мере, один аллостерический фермент, осуществляющий регуляцию суммарной реакции всего ферментного ансамбля. Чаще всего этот фермент катализирует скорость первой (самой медленной) реакции, а его отрицательным модулятором является конечный продукт всего процесса в целом.
Ниже представлена схема, изображающая мультиферментную систему, в которой продукт последней реакции является отрицательным эффектором аллостерического фермента Е^
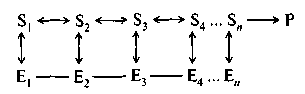
Мультиферментные системы могут включать в себя до 20 различных ферментов, функционирующих в определенной последовательности.
В настоящее время изучены многие мультиферментные комплексы, функционирующие на разных этапах метаболизма. Одним из таких комплексов является совокупность ферментов, катализирующих синтез пиримидинов из ас-партата в бактериальных клетках. Аллостерическим ферментом в данном случае является аспартат-карбомоилаза, катализирующая первую стадию процесса, а именно превращение аспартата в карбомоиласпартат.
Регуляция ферментативной активности может осуществляться за счет ограниченного протеолиза. Многие протеиназы, функционирующие вне клеток, например в крови или в пищеварительном тракте, синтезируются в виде неактивных предшественников. Активация их связана с гидролизом некоторых пептидных связей в полипептидной цепи. В качестве примера можно привести ферменты свертывания крови, а также такие ферменты пищеварительного тракта, как трипсин и химотрипсин и др.
Регуляция ферментативной активности может осуществляться за счет ковалентной обратимой модификации новосинтезированных белковых макромолекул. Это связано в первую очередь с ферментативным присоединением к ним низкомолекулярных химических группировок в результате фосфорилиро-вания, гликозилирования, метилирования и т. д. Присоединение фосфатной группы к гидроксилу аминокислотного остатка полипептидной цепи может как увеличить, так и снизить ферментативную активность. Примером тому может служить фосфорилаза — фермент, катализирующий отщепление остатков глюкозы от гликогена. В исходном состоянии он неактивен, но при фос-форилировании, осуществляемом посредством фермента протеинкиназы, происходит его активация и вовлечение в процесс метаболизма глюкозы. Напротив, фермент гликогенсинтаза активен в исходном состоянии, а при фос-форилировании его активность резко снижается.
Эффективным инструментом регуляции каталитической активности является молекулярная гетерогенность ферментов, обусловленная как генетическими, так и эпигенетическими факторами.
В настоящее время около половины идентифицированных ферментов находятся в клетках и тканях в виде множественных молекулярных форм, имеющих единую субстратную специфичность, но отличающихся по физико-химическим или иммунологическим свойствам. Генетическая основа молекулярной гетерогенности обусловлена наличием нескольких генов, каждый из которых кодирует одну субъединицу фермента или одну его молекулярную форму. Кроме того, различные молекулярные формы одного и того же фермента могут кодироваться в одном генном локусе, имеющем множественные аллели. Генетически детерминированные молекулярные формы называются изоэнзи-мами. Посттрансляционные модификации ферментов, обусловленные локальным протеолизом, ковалентными модификациями, белок-белковыми взаимодействиями и т.д., являются причиной образования множественных молекулярных форм, не являющихся истинными изоэнзимами, но играющими существенную роль в метаболических процессах. Наиболее часто встречаются так называемые конформеры — молекулярные формы, имеющие одинаковую первичную структуру, но отличающиеся по своей конформации. Это возможно в том случае, если эти конформации достаточно устойчивы, т. е. соответствуют уровню свободной энергии, близкой к минимальной. Только такие кон-формационные варианты белков, которые воспроизводимо фиксируются посредством электрофоретических, хроматографических или иных методов, могут рассматриваться как конформеры.
Множественные молекулярные формы ферментов
Участие множественных молекулярных форм ферментов в регуляции метаболизма можно проиллюстрировать на примере синтеза аминокислот у бактерий. У Е. coli аспартаткиназная реакция предшествует синтезу трех аминокислот: треонина, лизина, метионина. Имеются три изоэнзима аспартаткина-зы (АК-1, АК-2 и АК-3), которые по принципу обратной связи ингибируются соответствующими аминокислотами. Вообще регуляция метаболизма изофер-ментами основана на различии их некоторых свойств, влияющих на скорости каталитического процесса
Различия свойств изоферментов, влияющих на скорости ферментных реакций
Свойства (параметры) |
Ферменты, функционирующие в виде множественных форм |
Константа Михаэлиса |
Гексокиназа, пируваткиназа, глутаминаза, креатинкиназа |
Аллостерические свойства |
Гексокиназа, пируваткиназа, аспартаткиназа |
Субстрат и кофактор |
Альдолаза, изоцитратдегидрогеназа |
Внутриклеточная локализация |
Аргиназа, малатдегидрогеназа |
Влияние гормонов |
Пируваткиназа, гексокиназа |
Известны случаи, когда два изоэнзима одного фермента катализируют разнонаправленную ферментативную реакцию. Например, один из изоэнзи-мов лактатдегидрогеназы катализирует реакцию образования лактата из пиру-вата, а другой — образование пирувата из лактата.
ПРИМЕНЕНИЕ ФЕРМЕНТОВ
