
- •Введение предмет цитологии
- •Краткая история изучения клетки, методы цитологии
- •Общая характеристика и эволюция клеток
- •Поверхностный аппарат клеток Плазматическая мембрана
- •Функции плазматической мембраны
- •Цитоплазма клетки
- •Вакуолярная система цитоплазмы
- •Эндоплазматическая сеть
- •Шероховатая эндоплазматическая сеть
- •Гладкая эндоплазматическая сеть
- •Комплекс Гольджи
- •Лизосомы
- •Вакуоли растительных клеток
- •Пероксисомы
- •Двумембранные органеллы цитоплазмы
- •Митохондрии
- •Пластиды
- •Опорно-двигательная система клетки
- •Микрофиламенты
- •Микротрубочки
- •Промежуточные филаменты
- •Литература
- •Оглавление
Микрофиламенты
Основным химическим компонентом микрофиламентов является белок актин. Во многих эукариотических клетках на его долю приходится до 5% и более от общего количества белка клетки (например, в клетках фибробластов –8,5%, а в нейронах –10-15%). В поперечно-полосатых мышечных волокнах, где актин располагается в виде специфически упорядоченных структур, он составляет около 40% клеточного белка. Сравнение химического состава актина у различных представителей эукариот показало, что в процессе эволюции он претерпел лишь незначительные изменения. У большинства животных клеток актиновые нити и ассоциированные с ними белки образуют густую трехмерную сеть под плазматической мембраной. Эта часть цитоплазмы, называемая субмембранным, кортикальным слоем, или кортексом, придает механическую прочность поверхностному слою цитоплазмы, а также позволяет клетке изменять свою форму и двигаться.
В клетках актин встречается в двух формах. Мономерная форма актина - это глобулярный белок (G-актин), который в присутствие АТФ полимеризуется в фибриллярный (F-актин). Обычно в клетке фибриллы актина образованы двумя спиралями, обвивающими друг друга (рис. 25,26).

Рис. 25. Фибриллярный актин: две цепочки F актина, обвивающие друг друга. Мономеры актина представлены глобулярными молекулами
Микрофиламенты являются весьма динамичными структурами, способными собираться, расти и разбираться. Это связано с полярностью цепи F-актина: она может удлиняется, присоединяя новые глобулы G-актина, содержащего АТФ, с одного, плюс-конца, и укорачиваться с другого - минус-конца. Соотношение скорости этих процессов зависит от концентрации свободного актина. При достаточной концентрации G-актина в среде начинается спонтанная полимеризация актина, сопровождающаяся ростом нити. Причем первая стадия полимеризации – соединение трех первых мономеров идет медленно, присоединение же других глобул осуществляется быстрее. При недостаточной концентрации G-актина фибриллы начинают деполимеризоваться за счет отрыва глобул с минус-конца. Концентрация G-актина, при которой скорости ассоциации и диссоциации мономеров выравниваются, называется критической, в этом случае фибриллы F-актина сохраняют постоянную длину.
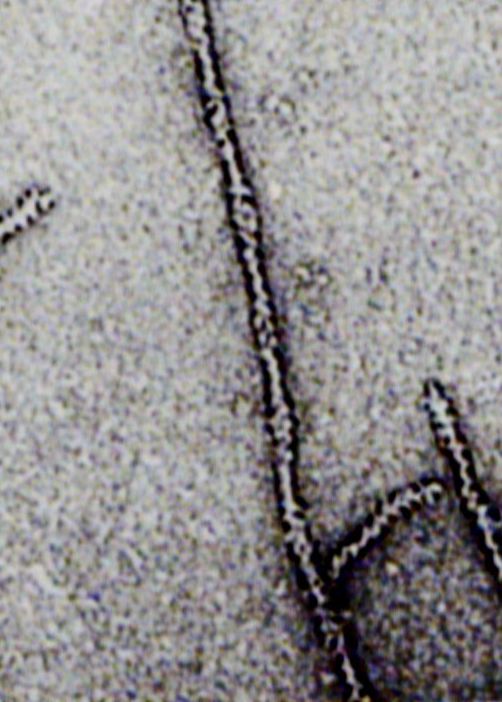
Рис. 26. Электронная микрофотография нити из очищенного F-актина
В цитоплазме большинства клеток 50% актина находится в неполимеризованной форме, т.е. в виде свободных мономеров или в комплексе с другими белками. Между ними и F-актином существует динамическое равновесие, что позволяет микрофиламентам участвовать в движении клеточной поверхности. Наиболее полно изменения клеточной поверхности изучены на примере образования пластинчатых выростов – ламеллоподий, с помощью которых ползущие клетки (например, фибробласты) передвигаются по субстрату. Давно было замечено, что в ламеллоподиях актиновые филаменты выглядят под электронным микроскопом более организованными, чем в других частях кортекса (рис. 27). При этом упорядоченные пучки микрофиламентов направлены к ведущему краю ламеллоподии, обеспечивающему движение клетки вперед, а плюс-концы филаментов упираются в плазматическую мембрану, которая имеет здесь небольшие начальные выросты. В этих условиях начинается перемещение молекул G-актина от одного конца (минус-конца) филамента, находящегося в глубине клетки, к другому (плюс-концу) у плазматической мембраны. В результате непрерывной полимеризации и деполимеризации актина непосредственно под плазматической мембраной происходит вытягивание переднего края клетки и движение клетки вперед. Следует отметить, что возникновение ламеллоподий и последующее перемещение в пространстве движущейся клетки требует участия особых регуляторных белков, функции которых заключаются в закреплении микрофиламентов на плазматической мембране, инициации полимеризации и деполимеризации актина и др.
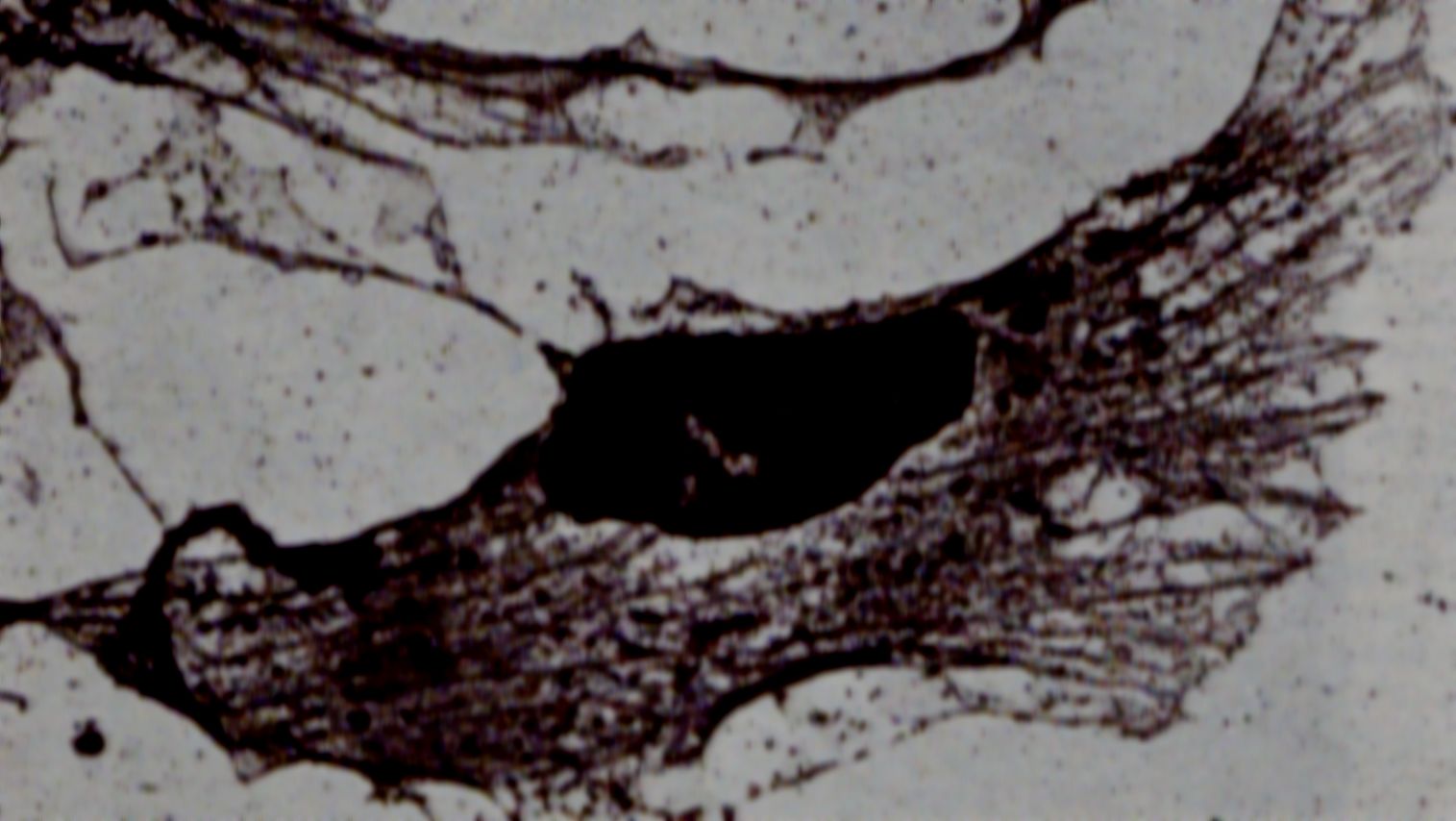
Рис. 27. Электронная микрофотография микрофиламентов в фибробласте
Нарушение процессов полимеризации и деполимеризации актина сопровождается нарушением многих форм клеточной подвижности. Так, цитохалазин, антибиотик, выделяемый различными плесневыми грибами, препятствуя упорядоченной агрегации актина (ингибитор полимеризации актина), подавляет фагоцитоз, цитокинез и образование ламеллоподий. Фаллоидин – яд бледной поганки, наоборот, стабилизирует агрегированную форму, подавляя деполимеризацию актина.
Актин является основным, но не единственным компонентом микрофиламентов, с ним часто связаны другие, специфические белки, называемые актинсвязывающими белками (АСБ). Функции этих белков многообразны и заключаются в организации и стабилизации фибриллярной сети, в агрегации F-актина в структуры более высокого порядка, в регуляции и управлении поведением микрофиламентов и т.д. Рассмотрим некоторые виды АСБ.
Белковые факторы, которые, инициируя процессы полимеризации и деполимеризации актина, участвуют в удлинении или укорачивании нитей и, в конечном счете, обеспечивают некоторые виды движения. Кроме того, к актинсвязывающим белкам относятся и вещества, являющиеся ингибиторами полимеризации актина. Так, в клетках позвоночных широко распространен тимозин β4 - небольшой полипептид, который стерически блокирует участок, отвечающий за связывание между собой мономеров актина.
1.Белки, участвующие в изменении агрегатного состояния кортикального слоя цитоплазмы. Сшивание актиновых филаментов в жесткие трехмерные сети обеспечивает фибриллярный белок филамин, состоящий из двух одинаковых полипептидных цепей, которые соединены «голова» к «голове». Участки, связывающие актиновые филаменты, находятся в «хвостовых» участках белковых молекул. Формирующиеся в местах пересечения филаментов сшивки способствуют переходу поверхностного слоя цитоплазмы из состояния жидкого золя в структурированный гель, придающий механическую устойчивость всему кортексу. Такие гибкие, но прочные связи между пересекающимися филаментами обеспечивают сохранение формы геля при приложении резкого короткого усилия, что, в свою очередь, позволяет клетке легко восстанавливать свою форму за счет упругости. Наоборот, гель деформируется за счет реорганизации контактов филамина с актином под действием более слабой постоянной силы. Противоположный эффект - переход структурированного геля в жидкий золь обеспечивает белок, называемый гельзолином. Взаимодействуя с актиновыми филаментами, он вызывает фрагментацию и разборку филаментов, что сопровождается разжижением геля. Причем этот процесс регулируется ионами кальция. Микроскопические исследования показали, что превращение геля в золь характерно для перетекания цитоплазмы во время движения клетки амебы. Кроме того, существует мнение, что переход актинового цитоскелета из геля в золь является важным этапом в процессе синаптической передачи в нервных клетках.
2.Белки, связывающие филаменты параллельно друг другу. В результате из них организуются плотные пучки (например, в присутствие АСБ фимбрина и фасцина), видимые даже в световой микроскоп. Такие высокоупорядоченные структурные формы могут тянуться через всю клетку, они не участвуют в движении клетки, но влияют на ее форму. Другие вытянутые сшивающие белки образуют рыхлые пучки, в которых актиновые филаменты отдалены друг от друга почти на 200 нм.
3.Белки, формирующие специализированные фибриллярные сети под плазматической мембраной клетки. Наиболее полно АСБ этого типа изучены на примере цитоскелета эритроцитов. Здесь в построении сети участвует спектрин – тетрамер, концы которого соединены с помощью коротких актиновых филаментов. Эта двумерная сеть обеспечивает гибкость клеток красной крови, позволяя им проходить сквозь узкие капилля
4.Белки, с помощью которых происходит закрепление пучков актиновых филаментов или фибриллярных сетей на плазматической мембране. К семейству актинсвязывающих белков этого типа относятся профилины, которые во многих клетках присоединяют актин к плазматической мембране, а также модулирует организацию актина, катализируя замену АДФ-актина на АТФ-актин. Аналогичные белки обнаружены в микроворсинках клеток кишечного эпителия. Это молекулы минимиозина, обладающие АТФазной активностью. Их головки связаныс актиновыми филаментами, а короткий хвост – с плазматической мембраной. Спектрин-актиновая сеть цитоскелета эритроцитов прикрепляется к интегральным белкам мембраны с помощью белка анкирина.
Белки миозинового типа – семейство сходных по строению и функции белков, обеспечивающих движение самой клетки и некоторые виды внутриклеточного транспорта. Вместе с актином миозин превращает энергию АТФ в механическую за счет механизма скольжения филаментов относительно друг друга. В поперечно-полосатых мышечных волокнах они формируют высокоупорядоченные структуры, являющиеся сократительными элементами мышц (рис. 28).

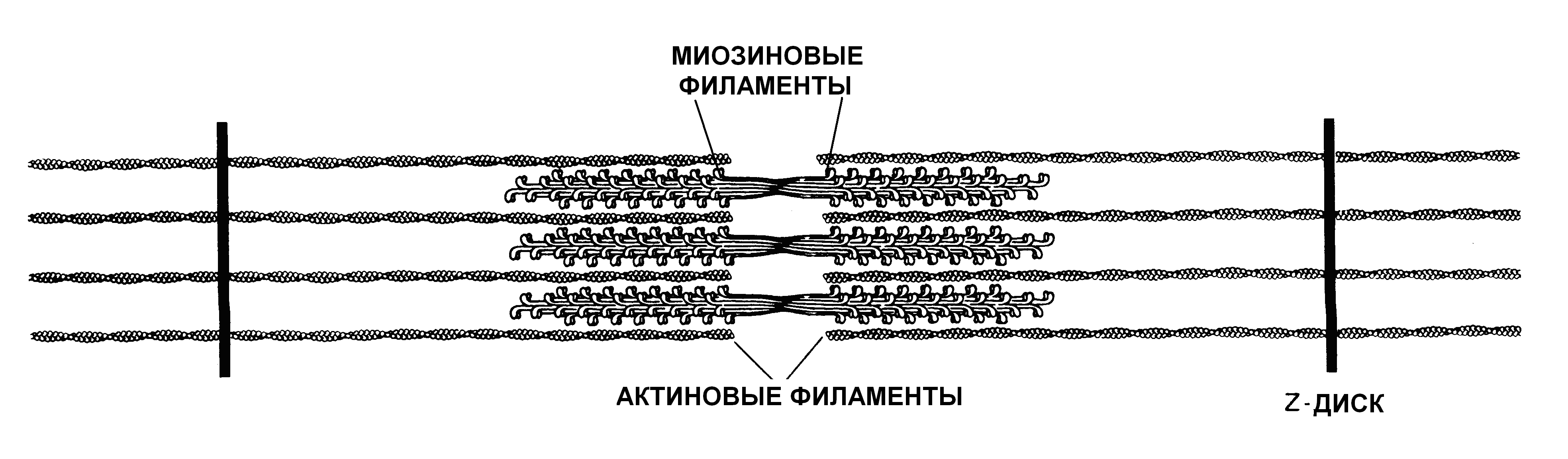
Рис. 28. Электронная микрофотография и схема строения миофибриллы поперечнополосатого мышечного волокна
В других клетках миозина меньше, и он находится в менее упорядоченной форме. В клетках головного мозга миозин составляет только 0,5%, в фибробластах – 3% общего белка. Все миозины содержат глобулярную часть – головку, обладающую АТФазной активностью, шейку, связанную с регуляторными белками, и хвост, структура которых специфична для каждого типа миозинов. В настоящее время известно три основных типа миозинов. Миозин I - это мономерная молекула; миозин II и миозин V представляют собой димеры, у которых полипептидные цепи закручены в суперспираль. В мышечных волокнах молекулы миозина II состоят из двух тяжелых и четырех легких цепей. Из тяжелых цепей формируются толстые нити, направленные друг к другу хвост к хвосту. Миозиновые головки, включающие легкие цепи, образуют поперечные мостики, связывающие нити миозина с актином. Хотя молекулы миозина в разных клетках отличаются, они похожи друг на друга в глобулярной части, чем обеспечивается неизменная АТФазная активность. Миозин I (минимиозин) и миозин V участвуют во взаимодействии цитоскелета с мембранами и в транспорте вакуолей.
