
- •Контактные методы измерения параметров окружающей среды
- •Содержание
- •Введение
- •Модуль 1
- •Перечень литературы рекомендованной к изучению модуля и подготовки к коллоквиуму из модуля 1 модуль 1
- •1.1 Краткая история развития аналитической химии
- •1.2 Классификация методов анализа
- •4. Общие сведения о методах измерения параметров окружающей среды. Основные требования к методам анализа
- •1.3. Структура, методы аналитической химии
- •1.4. Как достичь правильности анализа
- •1.4.1. Сравнение с данными другого метода
- •1.4.2. Сравнение с данными другой лаборатории
- •1.4.3. Стандартные образцы
- •3. Отбор и подготовка проб компонентов окружающей среды
- •Модуль 2
- •Перечень литературы рекомендованной к изучению модуля и подготовки к коллоквиуму из модуля 2
- •1. Гравиметрический (весовой) метод анализа
- •2. Титрометрические (объемные) методы анализа
- •1. Спектральный анализ
- •2. Люминесцентный анализ
- •3. Рефрактометрия
- •4. Денсиметрия
- •6. Магнитная спектроскопия
- •7. Атомно-абсорбционный метод
- •3.1 Физико-химические методы измерения параметров окружающей среды
- •2.Сущность наиболее широко используемых методов
- •2.1.Электрохимические методы анализа
- •2.1.1. Потенциометрия
- •Кулонометрические методы
- •Кондуктометрия
- •2.1.4. Электрогравиметрия
- •2.1.5. Вольтамперометрические методы
- •2.2. Спектральные и другие оптические методы
- •2.2.1. Эмиссионный спектральный анализ
- •2.2.2. Абсорбционная спектроскопия
- •2.2.3. Атомно-абсорбционный спектральный анализ
- •2.2.4. Люминесцентный анализ
- •2.2.5. Другие оптические методы
- •1.3.3. Биологические методы контроля
- •Учебное издание
- •Контактные методы измерения параметров окружающей среды
- •61077, Харьков, площадь свободы, 4
2.1.4. Электрогравиметрия
Электрогравиметрия – это безэталонный метод, применяющийся в настоящее время в основном для определения меди и анализа медных сплавов. Метод точный, однако, на проведение анализа требуется много времени.
Метод основан на измерении массы вещества, выделившегося в процессе электролиза на предварительно взвешенном электроде, обычно платиновой сетке. Электролиз можно проводить либо при постоянной силе тока, либо при постоянном потенциале. Если заданную величину потенциала электрода контролировать с помощью потенциостата, то можно раздельно определять компоненты смеси.
2.1.5. Вольтамперометрические методы
Вольтамперометрические методы анализа основаны на изучении зависимости силы тока от налагаемого на электролитическую ячейку внешнего напряжения. Вольтамперограмма служит источником информации об электродном процессе, протекающем на индикаторном электроде. В качестве последнего может выступать вращающийся или стационарный платиновый, графитовый электроды, стационарный ртутный. Если в качестве такого электрода применяют капающий ртутный электрод (его поверхность во время измерений возобновляется), то кривую зависимости силы тока от внешнего напряжения называют полярограммой (исторически сложившееся название). Характеристиками классической полярограммы являются потенциал полуволны, диффузионный ток и наклон (рис. 2.3).
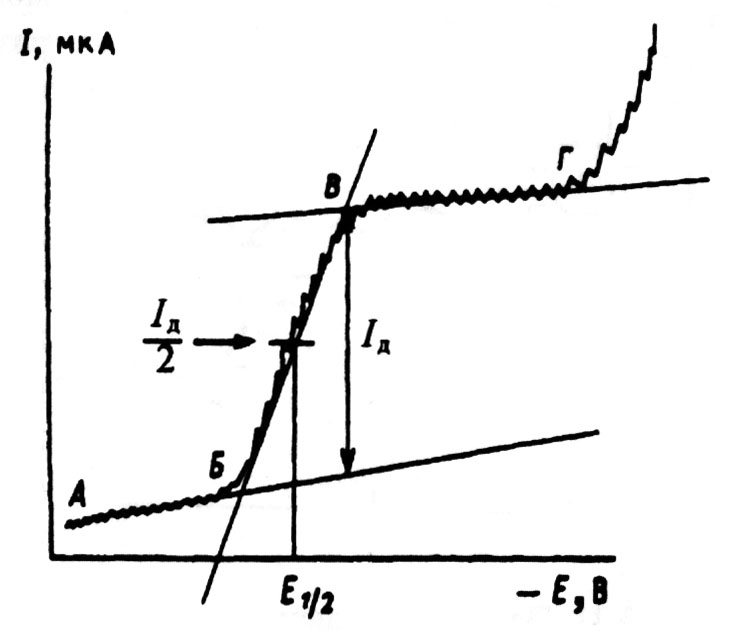
Рис.2.3. Классическая полярограмма
Потенциал полуволны Е1/2 (В) характеризует природу деполяризатора, поскольку он непосредственно связан с величиной Е0 данной окислительно-восстановительной системы:
![]()
где
ДM
и
![]() –
коэффициенты диффузии атома металла М
в ртути и иона металла Мn+
в растворе; fM
и
–
коэффициенты диффузии атома металла М
в ртути и иона металла Мn+
в растворе; fM
и
![]() – коэффициенты активности атома металла
в ртути и иона металла в растворе
соответственно; I
– диффузионный ток (мкА). Если при
регистрации полярограммы в ячейке
присутствует большое количество (0,1–
1 М) индифферентного электролита и
раствор не перемешивают, величина тока,
протекающего через ячейку, определяется
скоростью диффузии деполяризатора.
Предельный диффузионный ток (Iд)
или пропорциональная ему высота волны,
согласно уравнению Ильковича, линейно
зависит от концентрации деполяризатора
(восстанавливающегося иона) в растворе:
– коэффициенты активности атома металла
в ртути и иона металла в растворе
соответственно; I
– диффузионный ток (мкА). Если при
регистрации полярограммы в ячейке
присутствует большое количество (0,1–
1 М) индифферентного электролита и
раствор не перемешивают, величина тока,
протекающего через ячейку, определяется
скоростью диффузии деполяризатора.
Предельный диффузионный ток (Iд)
или пропорциональная ему высота волны,
согласно уравнению Ильковича, линейно
зависит от концентрации деполяризатора
(восстанавливающегося иона) в растворе:
![]()
где n – число электронов; Д – коэффициент диффузии, см2с-1; m – скорость вытекания ртути, мгс-1; t – время жизни капли, с; С – концентрация, ммоль/л.
Эта зависимость служит основой количественного полярографического анализа.
Наклон полярограммы позволяет оценить обратимость электродного процесса или число электронов, участвующих в нем.
Если
в растворе находится несколько веществ,
потенциалы которых различаются на 100
мВ и больше, то на полярограмме будет
не одна волна, а несколько – по числу
восстанавливающихся ионов (рис. 2.4). Для
анализа смесей, содержащих ионы или
вещества с близкими потенциалами
полуволны, применяют методы дифференциальной
полярографии, использующие кривые
![]() .
.
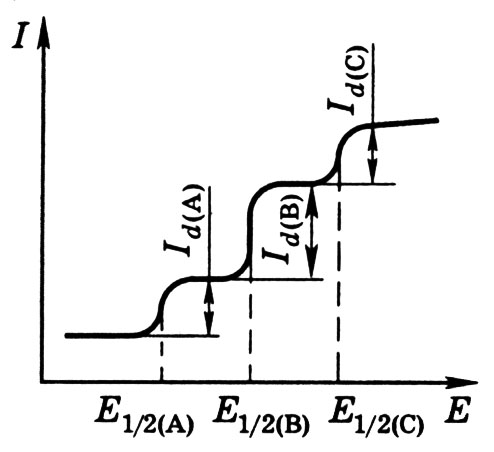
Рис.2.4. Полярограмма при наличии в растворе восстанавливающихся
веществ А, В и С
Современными улучшенными вариациями полярографии являются осциллографическая полярография, инверсионная вольтамперометрия, импульсная полярография. Так, например, инверсионная вольтамперометрия дает существенное увеличение чувствительности (на 2-3 порядка по сравнению с обычной полярографией) за счет выделения определяемого элемента из очень разбавленного раствора и накопления его на электроде.
Объектами вольтамперометрического анализа являются не только неорганические, но и многие органические вещества, способные к электрохимическим превращениям. К вольтамперометрически активным группировкам относятся, например, > СНО, > С = N, - NO2, - O – O -, - S – S – и другие.
Рассмотренные методы принадлежат прямой вольтамперометрии. Вращающиеся платиновые, графитовые и другие твердые электроды применяются и в косвенном методе – амперометрическом титровании. В процессе этого титрования после прибавления отдельных порций титранта отмечают силу тока и строят кривую в координатах сила тока – объем титранта. Точку эквивалентности находят графически по перегибу кривой.
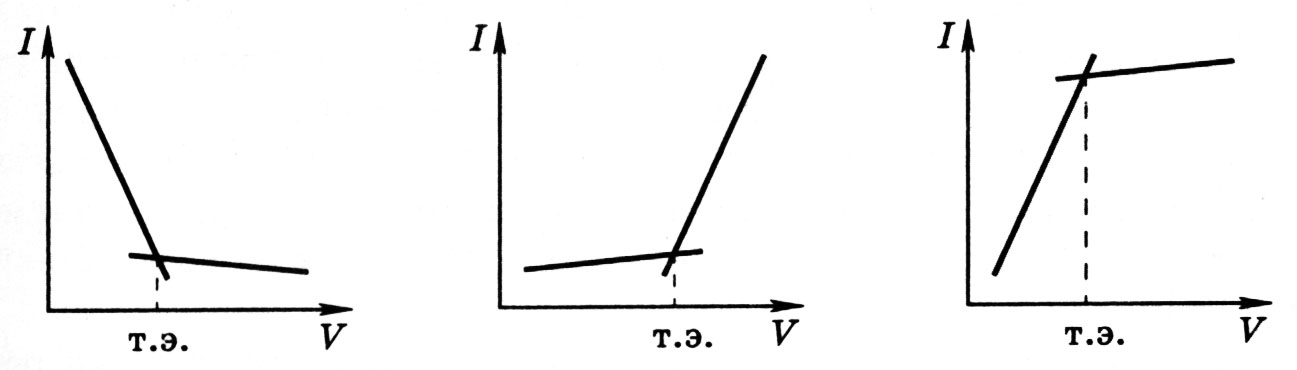
а б в
Рис.2.5. Кривые амперометрического титрования: электроактивно определяемое вещество (а), титрант (б) и продукт реакции (в).
Достоинством метода амперометрического титрования, по сравнению с прямой вольтамперометрией, является прежде всего экспресность и простота и, кроме того, возможность определять также неэлектроактивные вещества.
