
Лабораторна робота № 4
Тема: визначення критичної концентрації міцелоутворення поверхнево-активних речовин
Мета: Визначити критичну концентрацію міцелоутворення ПАР фотомет-ричним методом.
1. Критична концентрація міцелоутворення поверхнево-активних речовин
Поверхнево-активні речовини це речовини, які при розчиненні знижують поверхневий натяг утвореного розчину. До таких речовин відносяться практично всі розчинні у воді органічні речовини, що мають дифільну природу, тобто у молекулі поєднанні гідрофільні (СООН, СОН, NH2 та інші функціональні групи) та гідрофобні (вуглеводневий ланцюг, ароматичне кільце) властивості. Поверхнево-активні речовини поділяються на молекулярні та колоїдні ПАР. Перші не мають великого використання. Другі ж завдяки властивості при досягненні певної концентрації в розчині утворювати агрегати, що називаються міцелами, дістали широке практичне використання у всіх сферах людського життя.
Колоїдні поверхнево-активні речовини (ПАР) поділяються на аніонактивні, катіонактивні та неіоногенні. Молекули всіх типів ПАР мають яскраво виражений дифільний характер – містять довголанцюговий радикал (понад 10-15 вуглецевих атомів) та полярну групу, яка здатна до гідратації.
Основною причиною виникнення у водних розчинах агрегатів із вуглеводневих ланцюгів є когезійні сили між молекулами води, котрі є більші ніж взаємне притягання молекул води та вуглеводневих радикалів молекул ПАР. Молекули води ніби витискуюь вуглеводневі ланцюги із розчину, що супроводжується зменшенням ентальпії системи. Утворенню міцел протистоять сили взаємного відштовхування гідрофільних частинок молекул ПАР. Для іонних ПАР це відштовхування зумовлено електростатичною взаємодією одноіменно заряджених іоногенних груп, для неіоногенних ПАР – осмотични-ми силами, які виникають через підвищення концентрацій оксіетиленових ланцюгів в перифирійній частині міцел. Крім цього, утворенню міцел протидіє зниження ентропії через зростання при агрегації впорядкованості системи. Зростання енергії відштовхування полярних груп і зменшення ентропії компенсує зниження енергії системи при агрегації вуглеводневих ланцюгів і приводить до встановлення рівноважних значень ККМ і розміру міцел.
При невисоких концентраціях ПАР водні розчини є молекулярні, а збільшення концентрації призводить до утворення міцел дифільних молекул. Розчин стає колоїдним. Рівновага між молекулярно- та міцелярно-розчиненими частинками ПАР є динамічною і залежить від температури і концентрації ПАР
молекулярний розчин ПАР міцелярний розчин ПАР. (1)
Міцели в розчині утворюються, якщо досягається деяке значення концентрації ПАР, яка називається критичною концентрацією міцелоутворення (ККМ). У водних розчинах завдяки силам міжмолекулярної взаємодії між вуглеводневими ланцюгами відбувається асоціація молекул ПАР з утворенням сферичних міцел при досягненні в розчині необхідної за даних умов кон-центрації. Зміна структури розчину під час утворення міцел призводить до різкої зміни його фізико-хімічних властивостей (поверхневого натягу, електро-провідності, оптичних властивостей та ін.) залежно від концентрації ПАР (рис. 1). На цьому і грунтуються експериментальні методи визначення ККМ.
Р


Зі збільшенням концентрації ПАР у розчині сферичні міцели перетворюються у паличкоподібні, а потім у пластинчас-тіламелі (рис. 2). Дисоціація іоногенних груп призводить до утворення подвійного електричного шару навколо сферичної міцели, тому взаємодія міцел у розчині має електростатичний характер.
Р
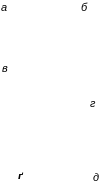 ис.
2. Схематичне зображення міце-лярних
агрегатів в залежності від кон-центрації
поверхнево активної речовини у розчині:
а
– сферична (пряма) міцела, б
– паличкоподібна міцела, в
– дископодібна міцела, г
– везикула, ґ
– ламель, д
– губчаста фаза
ис.
2. Схематичне зображення міце-лярних
агрегатів в залежності від кон-центрації
поверхнево активної речовини у розчині:
а
– сферична (пряма) міцела, б
– паличкоподібна міцела, в
– дископодібна міцела, г
– везикула, ґ
– ламель, д
– губчаста фаза
На ККМ в розчинах ПАР може впливати ряд факторів, зокрема, молеку-лярна вага ПАР, температура, природа розчинника та ін.). При збільшенні довжини вуглеводневого радикалу ККМ знижується. Це зумовлено зменшенням істинної розчинності із збільшенням довжини вуглеводневого радикалу і зростанням здатності до асоціації. Вплив температури різний для різних ПАР. Для іоногенних – ККМ зазвичай підвищується із підвищенням температури внаслідок дезагрегуючої дії теплового руху молекул. Однак, цей ефект не є настільки великим тому, що він послаблюється гідрофобною взаємодією, яка супроводжується збільшенням ентропії системи. Тому вплив температури на ККМ проявляється тим слабше, чим більше виражені гідрофобні властивості ПАР. Для неіоногенних ПАР ККМ завжди зменшується при підвищенні температури водневі зв’язки між етерними атомами кисню і молекулами води руйнуються і взаємне відштовхування, перешкоджає агрегуванню.
Для міцелярних розчинів ПАР є характерним процес солюбілізації нерозчинних у воді рідин, барвників та дрібнодисперсних пігментів, порошків.
Останні піддаються колоїдному диспергуванню.
Значення ККМ іоногенних ПАР зменшується при введенні в розчин індеферентних електролітів і мало впливає на ККМ неіоногенних ПАР. Введення неелектролітів (органічних розчинників) при наявності солюбілізації приводить до підвищення стійкості міцел, тобто до зменшення ККМ у водних розчинах ПАР. У відсутності солюбілізації, зазвичай, ККМ збільшується за рахунок посилення розчинюючої дії середовища.
У водних міцелярних розчинах солюбілізуються речовини, нерозчинні у воді (гексан, бензол, масла, барвники та ін.). Солюбілізація - важливий фактор мийної дії ПАР. Крім солюбілізації, колоїдні поверхнево-активні речовини використовують як стабілізатори дисперсних систем (наприклад пін, емульсій) для зниження міцності під час подрібнення, як складові мастильних матеріалів і для зміни характеру поверхні (гідрофілізація чи гідрофобізація).
Методами світлорозсіювання і дифузії були визначені розміри міцел. Міцелярна маса в залежності від типу ПАР коливається від декількох тисяч до сотень тисяч. Число молекул, що складають міцелу (число агрегації), також знаходиться в широких межах. Число агрегації є характеристикою міцелярних утворень ПАР.
