
- •Ответы на госэкзамены
- •2. Примерный состав продуктов сгорания и способы его измерения.
- •3.Способы измерения расходов теплоносителей и учета тепловой энергии в системах отопления и гвс
- •4.Основные газовые законы. Уравнение состояния идеального газа.
- •4. Закон Авогадро
- •5 .6. Уравнение основных термодинамических процессов идеального газа. Графики основных термодинамических процессов идеального газа в p-V и t-s диаграммах.
- •7.Какой процесс остается неизменным в адиабатном процессе и почему?
- •8.Что такое энтальпия? Как изменяется энтальпия в процессе дросселирования идеального газа?
- •9.Первый закон термодинамики и его записи через внутреннюю энергию и энтальпию?
- •10.Записать формулу для расчета количества тепла, необходимого для нагрева м кг газа на при постоянном давлении и объеме?
- •11.Как определить среднюю в интервале температур t1 и t2 теплоемкость по табличным значениям от 00 до t10c и до t20c соответственно. Чему равна теплоемкость в адиабатическом процессе?
- •13. Дайте одну из формулировок 2-го закона термодинамики? Приведите его математическую запись.
- •14.Принцип работы вечных двигателей 1-го и 2-го рода.
- •15. Опишите процесс сжатия газов в компрессоре в pv и ts координатах.
- •16.Что такое помпаж и как его избежать?
- •23.От чего зависит и каков порядок кпд современных тепловых двигателей (двс, гту, пту, пгу)?
- •24.Уравнение 1 закона термодинамики для потока
- •26.Цикл гту и его кпд
- •27. Цикл Ренкина и его кпд.
- •28.Способы повышения эффективности использования топлива в цикле Ренкина.
- •29.Цикл пгу и его кпд
- •30. 31.Что такое эксергия рабочего тела, потока и тепла? Расчет эксергии теплоты и потока рабочего тела.
- •33.Влажный воздух и его характеристики
- •36.Основные способы распространения тепла.
- •37.Основные законы теплопроводности- закон Фурье.
- •38.Что такое коэффициент теплопроводности, его размерность, от чего зависит его величина, где его взять для выполнения расчетов?
- •39.Порядок величины коэффициента теплопроводности для различных веществ.
- •40.Виды конвекции, и чем они отличаются.
- •41. Основное уравнение конвективного теплопереноса - уравнение Ньютона.
- •42.Что такое коэффициент теплоотдачи, его размерность, как его определить для выполнения расчетов?
- •43.От чего зависит коэффициент теплоотдачи? Порядок его величины для различных случаев теплообмена.
- •44.Почему зависимости для определения коэффициента теплоотдачи представляются в безразмерной форме.
- •45.Что такое коэффициент теплопередачи, и от чего он зависит?
- •46.Закон Стефана-Больцмана.
- •47.Как расчесать тепловой поток теплопроводностью через плоскую стенку?
- •48. Как расчесать тепловой поток теплопроводностью через многослойную плоскую стенку?
- •50.Термическое сопротивление теплопередачи для плоской и цилиндрической стенки.
- •51.Из чего складывается термическое сопротивление теплопередачи через многослойную стенку?
- •52. От каких критериев зависит безразмерный коэффициент теплопередачи при вынужденной и естественной конвекции?
- •53.Как расчесать тепловой поток излучением между двумя бесконечно плоскими стенками? Между телами произвольной формы?
- •54.Как расчесать коэффициент теплопередачи излучением между объемом излучающего газа (пылевзвеси) и окружающими его стенками (топочными экранами)?
- •55.Понятие термического сопротивления теплоотдачи, теплопроводности, теплопередачи. Число Био и его смысл.
- •56.Как рассчитать средний температурный напор в теплообменнике? При каких условиях среднелогарифмический напор можно заменить среднеарефмитическим?
- •57.Виды теплообменников и области их преимущественного применения.
- •61.Для чего нужны теории подобия и анализ размерностей.
- •67.Нарисуйте график изменения давления по длине водяной тепловой сети для произвольно выбранного профиля местности и высоты зданий - теплопотребителей.
- •68. Что называется коэффициентом теплофикации?
- •73.Понятие щелочности воды. Метод ее определения.
- •74.Понятие жесткости воды. Методы ее определения.
- •75. Какие виды жесткости бывают, и какие из них наиболее опасны для паровых и водогрейных котлов?
- •76. Показатель концентрации ионов водорода в воде –рН.
- •77. Назначение Na-катионирование. Как меняются при этом свойства воды?
- •79. Назначение он-катионирование. Как меняются при этом свойства воды?
- •105.Каковы причины использования много ступенчатых нагнетателей?
- •106. Причины возникновения и способы компенсации осевой силы в нагнетателях.
- •107. Основные типы энергетических насосов (по назначению).
- •108. Что такое самотяга дымовой трубы.
7.Какой процесс остается неизменным в адиабатном процессе и почему?
Адиабатный процесс -это процесс
протекающий без теплообмена с окружающей
средой
![]()
Под энтропией тела можно понимать
величину, изменения которой
![]() в
любом элементарном термодинамическом
процессе равно отношению внешнего
тепла
в
любом элементарном термодинамическом
процессе равно отношению внешнего
тепла
![]() ,
участвующий в этом процессе, к абсолютной
температуре тела
,
участвующий в этом процессе, к абсолютной
температуре тела![]() , dS=0, S=сonst
, dS=0, S=сonst
Энтропия –это термодинамический параметр системы, j характеризует степень порядка в системе.
Для адиабатного процесса, протекающего без теплообмена газа с внешней средой (dq=0)
S1=S2=S=const,
т.к. в этом процессе q=0, то
![]() ,
адиабатный процесс в T-S
диаграмме изображается прямой линией.
,
адиабатный процесс в T-S
диаграмме изображается прямой линией.
![]() (является качественной характеристикой
процесса преобразования).
(является качественной характеристикой
процесса преобразования).
В уравнении абсолютная температура Т
величина всегда положительная , тогда
![]() и
имеют
одинаковые знаки, т.е если
положительно,
то
положительно, и наоборот. Таким образом
в обратимых процессах с подводом тепла
(
>0)
энтропия газа увеличивается, а в обратимых
с отводом тепла уменьшается- это важное
свойство параметра S.
и
имеют
одинаковые знаки, т.е если
положительно,
то
положительно, и наоборот. Таким образом
в обратимых процессах с подводом тепла
(
>0)
энтропия газа увеличивается, а в обратимых
с отводом тепла уменьшается- это важное
свойство параметра S.
Изменение энтропии зависит лишь от начального и конечного состояния рабочего тела.
8.Что такое энтальпия? Как изменяется энтальпия в процессе дросселирования идеального газа?
Энтальпия (теплосодержание, от греч. нагревать)
Энтальпия - это сумма внутренней энергии газа и потенциальной энергии, давления
обусловленное действием внешних сил.
I=U+PV,
где U-внутренняя энергия 1 кг газа.
PV-работа проталкивания, при этом Р и V соответственно давление и удельный объём при температуре, для которой определена внутренняя энергия.
Энтальпию измеряют в тех же единицах, что и внутреннюю энергию (кДж/кг или
ккал/кг).
Энтальпия идеального газа определяется следующим способом:
Так как входящие в нее величины являются функциям состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности Величина
h=u+pv,
называемая удельной энтальпией (h=Н/М), представляет собой энтальпию системы содержащей 1 кг вещества, и измеряется в Дж/кг.
Изменение энтальпии. в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
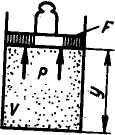
Физический смысл энтальпии выясним на следующем примере. Рассмотрим
расширенную
систему, включающую газ в
цилиндре и поршень с грузом общим весом
в
(рис.
2.4). Энергия этой системы складывается
из внутренней энергии газа
и потенциальной энергии поршня с
грузом в поле внешних сил: если
давление системы сохраняется неизменным,
т. е. осуществляется изобарный
процесс (dp=0),то
![]()
т. е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы.
![]()
9.Первый закон термодинамики и его записи через внутреннюю энергию и энтальпию?
Первый закон термодинамики является приложением закона сохранения и превращения энергии к тепловым явлениям. Напомним, что сущность закона сохранения и превращения энергии, являющегося основным, законом естествознания, состоит в том, что энергия не создаётся из ничего и не исчезает бесследно, а превращается из одной формы в другую в строго определённых количествах. Энергия вообще - это свойство тел, при определённых условиях совершающее работу.
Под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами. Внутренняя энергия это функция состояния
Первый закон термодинамики: теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы
![]() и
и
![]()
Первый
закон термодинамики для энтальпии:![]()
l’-внешняя располагаемая работа –это работа совершаемая за пределами системы, с целью возврата системы в состояния равновесия
