
- •Ответы на госэкзамены
- •2. Примерный состав продуктов сгорания и способы его измерения.
- •3.Способы измерения расходов теплоносителей и учета тепловой энергии в системах отопления и гвс
- •4.Основные газовые законы. Уравнение состояния идеального газа.
- •4. Закон Авогадро
- •5 .6. Уравнение основных термодинамических процессов идеального газа. Графики основных термодинамических процессов идеального газа в p-V и t-s диаграммах.
- •7.Какой процесс остается неизменным в адиабатном процессе и почему?
- •8.Что такое энтальпия? Как изменяется энтальпия в процессе дросселирования идеального газа?
- •9.Первый закон термодинамики и его записи через внутреннюю энергию и энтальпию?
- •10.Записать формулу для расчета количества тепла, необходимого для нагрева м кг газа на при постоянном давлении и объеме?
- •11.Как определить среднюю в интервале температур t1 и t2 теплоемкость по табличным значениям от 00 до t10c и до t20c соответственно. Чему равна теплоемкость в адиабатическом процессе?
- •13. Дайте одну из формулировок 2-го закона термодинамики? Приведите его математическую запись.
- •14.Принцип работы вечных двигателей 1-го и 2-го рода.
- •15. Опишите процесс сжатия газов в компрессоре в pv и ts координатах.
- •16.Что такое помпаж и как его избежать?
- •23.От чего зависит и каков порядок кпд современных тепловых двигателей (двс, гту, пту, пгу)?
- •24.Уравнение 1 закона термодинамики для потока
- •26.Цикл гту и его кпд
- •27. Цикл Ренкина и его кпд.
- •28.Способы повышения эффективности использования топлива в цикле Ренкина.
- •29.Цикл пгу и его кпд
- •30. 31.Что такое эксергия рабочего тела, потока и тепла? Расчет эксергии теплоты и потока рабочего тела.
- •33.Влажный воздух и его характеристики
- •36.Основные способы распространения тепла.
- •37.Основные законы теплопроводности- закон Фурье.
- •38.Что такое коэффициент теплопроводности, его размерность, от чего зависит его величина, где его взять для выполнения расчетов?
- •39.Порядок величины коэффициента теплопроводности для различных веществ.
- •40.Виды конвекции, и чем они отличаются.
- •41. Основное уравнение конвективного теплопереноса - уравнение Ньютона.
- •42.Что такое коэффициент теплоотдачи, его размерность, как его определить для выполнения расчетов?
- •43.От чего зависит коэффициент теплоотдачи? Порядок его величины для различных случаев теплообмена.
- •44.Почему зависимости для определения коэффициента теплоотдачи представляются в безразмерной форме.
- •45.Что такое коэффициент теплопередачи, и от чего он зависит?
- •46.Закон Стефана-Больцмана.
- •47.Как расчесать тепловой поток теплопроводностью через плоскую стенку?
- •48. Как расчесать тепловой поток теплопроводностью через многослойную плоскую стенку?
- •50.Термическое сопротивление теплопередачи для плоской и цилиндрической стенки.
- •51.Из чего складывается термическое сопротивление теплопередачи через многослойную стенку?
- •52. От каких критериев зависит безразмерный коэффициент теплопередачи при вынужденной и естественной конвекции?
- •53.Как расчесать тепловой поток излучением между двумя бесконечно плоскими стенками? Между телами произвольной формы?
- •54.Как расчесать коэффициент теплопередачи излучением между объемом излучающего газа (пылевзвеси) и окружающими его стенками (топочными экранами)?
- •55.Понятие термического сопротивления теплоотдачи, теплопроводности, теплопередачи. Число Био и его смысл.
- •56.Как рассчитать средний температурный напор в теплообменнике? При каких условиях среднелогарифмический напор можно заменить среднеарефмитическим?
- •57.Виды теплообменников и области их преимущественного применения.
- •61.Для чего нужны теории подобия и анализ размерностей.
- •67.Нарисуйте график изменения давления по длине водяной тепловой сети для произвольно выбранного профиля местности и высоты зданий - теплопотребителей.
- •68. Что называется коэффициентом теплофикации?
- •73.Понятие щелочности воды. Метод ее определения.
- •74.Понятие жесткости воды. Методы ее определения.
- •75. Какие виды жесткости бывают, и какие из них наиболее опасны для паровых и водогрейных котлов?
- •76. Показатель концентрации ионов водорода в воде –рН.
- •77. Назначение Na-катионирование. Как меняются при этом свойства воды?
- •79. Назначение он-катионирование. Как меняются при этом свойства воды?
- •105.Каковы причины использования много ступенчатых нагнетателей?
- •106. Причины возникновения и способы компенсации осевой силы в нагнетателях.
- •107. Основные типы энергетических насосов (по назначению).
- •108. Что такое самотяга дымовой трубы.
4.Основные газовые законы. Уравнение состояния идеального газа.
Ответ:
Идеальный газ-газ не имеющий объема молекула является геометрической точкой и отсутствуют силы взаимодействия между молекулами.
Рассмотрим 1 кг газа.![]() ,
где R –газовая постоянная
,
где R –газовая постоянная![]() ,
(Дж/кг.К)-уравнение Менделеева –Клепейрона
,
(Дж/кг.К)-уравнение Менделеева –Клепейрона
Умножив на М, получим уравнение состояния для произвольной массы газа М:
![]()
![]() -молярная
масса, кг/моль.
-молярная
масса, кг/моль.
Закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов
![]()
Парциальное давление рi-давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
1). Массовой долей называется отношение массы отдельного компонента Мi к смеси М:
![]() ,
,
Очевидно, что
![]() и
и
![]()
2). Объемные доли представляют собой
отношение приведенного объема газа Vi
r полному объему смеси
V:
![]() ,
,
где Vi- приведенный объем газа-объем , который имел бы газ, если бы один находился при температуре и давление смеси.
![]() и
и
![]()
3). Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей N.
![]()
Закон Бойля - Мариотта
![]()
Закон Гей-Люссака. 1
Французский физик и химик Ж.Л.Гей-Люссак в 1802 году на основании опытных данных установил линейную зависимость объема газов от температуры при постоянном давлении, т.е
![]()
пои постоянном давлении, т.е.
![]()
Закон Шарля
установил закон изменения давления газов с изменением температуры при постоянном объёме. Этот закон, так же, как и закон Гей-Люссака, описывается линейной зависимостью давления от температуры
![]()
4. Закон Авогадро
Этот закон, сформулированный итальянским физиком и химиком А.Авогадро в 1811 году, гласит: при одинаковых температурах и давлениях одинаковые объёмы любых газов содержат одно и то же число молекул. ' Исходя из сформулированного им же закона о пропорциональности объёмов и масс вступающих в химическую реакцию газов, Авогадро удалось также вычислить число молекул, содержащихся в одном киломоле любого газа, так называемую постоянную (или число) Авогадро:
![]()
В терминах макроскопических параметров закон Авогадро формулируется следующим образом: один киломоль любого газа при нормальных физических условиях занимает один и тот же объём, равный V0 =22.4136 м3/кмоль.
5 .6. Уравнение основных термодинамических процессов идеального газа. Графики основных термодинамических процессов идеального газа в p-V и t-s диаграммах.
Ответ:
Изменение состояния термодинамической системы во времени называется термодинамическим процессом.
Изохорный процесс - это процесс протекающий при постоянном объеме.
Из уравнения состояния идеального газа
следует, что
![]() ,
т.е. давление газа прямо пропорционально
его абсолютной температуре:
,
т.е. давление газа прямо пропорционально
его абсолютной температуре:
![]()
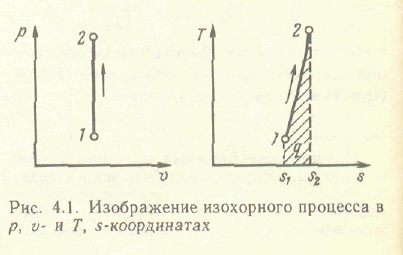
Количество теплоты, подведенной к рабочему телу в процессе 1 2 при cv=const, определяется из соотношений

При переменной теплоемкости
![]()
где
![]() -средняя
массовая изохорная теплоемкость в
интервале температур от t1
до t2.
-средняя
массовая изохорная теплоемкость в
интервале температур от t1
до t2.
Т.к. l=0, то в соответствии
с первым законом термодинамики
![]() и
и
![]() при cv=const;
при cv=const;
![]() при сv=var.
при сv=var.
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то формулы справедливы для любого термодинамического процесса идеального газа.
Изменение энтропии в изохорном процессе определяется по формуле:
![]() ,
,
т.е. зависимость энтропии от температуры на изохоре при cv=const имеет логарифмический характер.
Изобарный процесс-это процесс,
протекающий при постоянном давлении.
Из уравнения состояния идеального газа
следует, что при p=const
находим
![]() ,
или
,
или
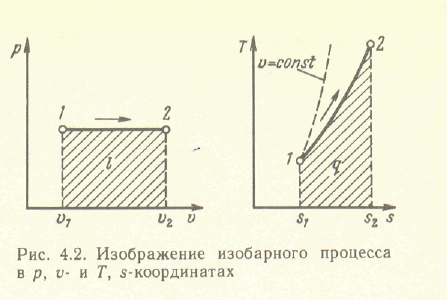
![]() ,
,
т.е. в изобарном процессе объем газа пропорционален его абсолютной температуре. На рисунке изображен график процесса
Рис. Изображение изобарного процесса в p, v- и T, s-координатах
Из выражения следует, что
 .
.
Так как
![]() и
и
![]() ,
то одновременно
,
то одновременно
![]() .
.
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения
 ,
,
![]() -
средняя массовая изобарная теплоемкость
в интервале температур от t1
до t2; при cp=const
-
средняя массовая изобарная теплоемкость
в интервале температур от t1
до t2; при cp=const
![]() .
.
Изменение энтропии при cp=const
согласно равно
![]() ,
т.е. температурная зависимость энтропии
при изобарном процессе тоже имеет
логарифмический характер, но поскольку
сp>cv,
то изобара в Т-S- диаграмме
более полого, чем изохора.
,
т.е. температурная зависимость энтропии
при изобарном процессе тоже имеет
логарифмический характер, но поскольку
сp>cv,
то изобара в Т-S- диаграмме
более полого, чем изохора.
Изотермический процесс- это процесс,
протекающий при постоянной температуре.
![]() или
или
![]() ,
т.е давление и объем обратно пропорциональны
друг другу, так что при изетермическом
сжатии давление газа возрастает , а при
расширении падает.
,
т.е давление и объем обратно пропорциональны
друг другу, так что при изетермическом
сжатии давление газа возрастает , а при
расширении падает.
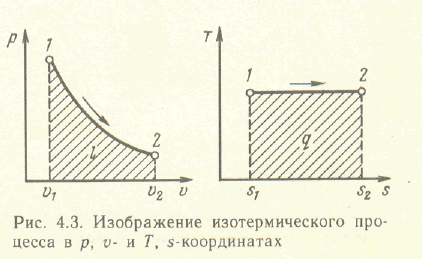 Работа
процесса
Работа
процесса
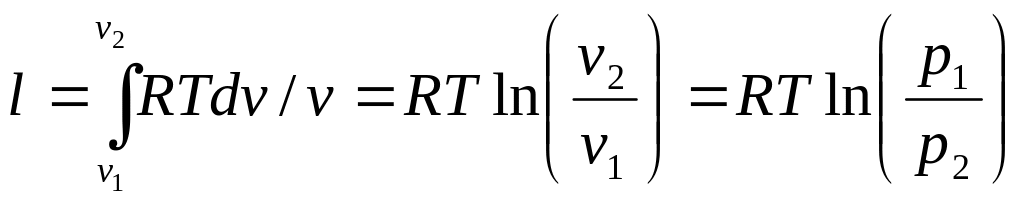
Так как температура не меняется то
![]() и вся подводимая теплота превращается
в работу расширения q=l.
и вся подводимая теплота превращается
в работу расширения q=l.
Изменение энтропии равно
![]()
Адиабатный
процесс. Процесс,
происходящий
без теплообмена с окружающей
средой, называется адиабатным,
т. е.
![]() .
.
Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
Уравнения первого закона термодинамика для адиабатного процесса принимают вид: cpdT — vdp = 0; codT' + pdv = 0. Поделив первое уравнение на второе, получим
![]() или
или
![]()
П осле
интегрирования получим
осле
интегрирования получим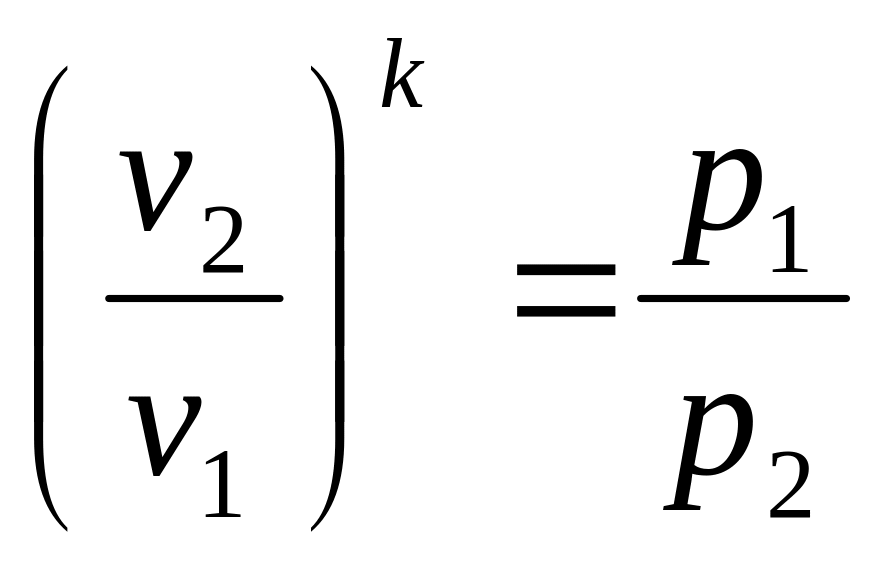 или
или
![]() .
.
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const). Величина
![]()
называется показателем адиабаты. Подставив cp = cv+R, получим k=1+R/cv
Величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k =1,66, для двухатомного k =1,4, для трех-и многоатомных газов k = 1,33.
Поскольку k > 1, то в координатах р, v (рис. 4.4) линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Определив из уравнения состояния, написанного для состояний 1 и 2, отношение объемов или давлений и подставив их, получим уравнение адиабатного процесса в форме, выражающей зависимость температуры от объема или давления
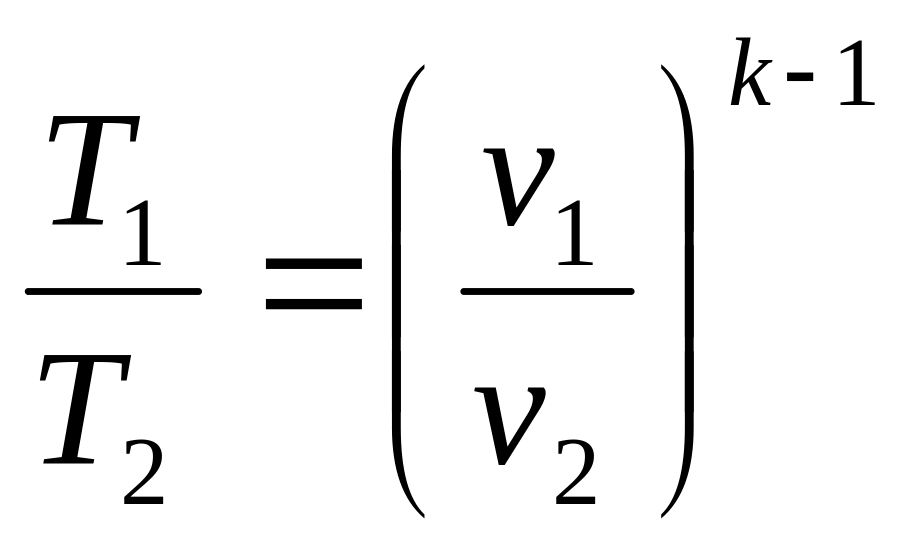 ,
,

Любой процесс можно описать в p,
v-координатах уравнением
![]() подбирая соответствующее значение n.
Процесс, описываемый этим уравнением,
называется политропным.
подбирая соответствующее значение n.
Процесс, описываемый этим уравнением,
называется политропным.
Для данного процесса n является величиной постоянной.
Из уравнений можно получить
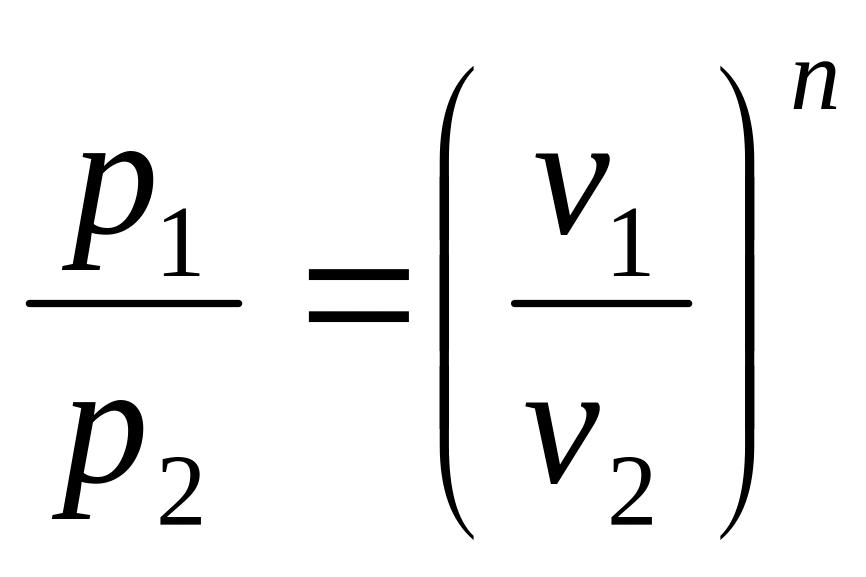 ,
,
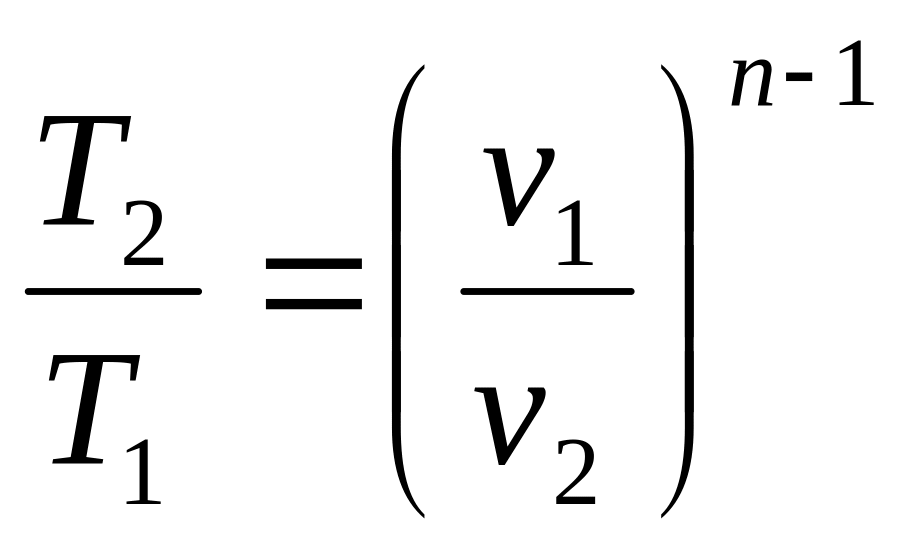 ,
,
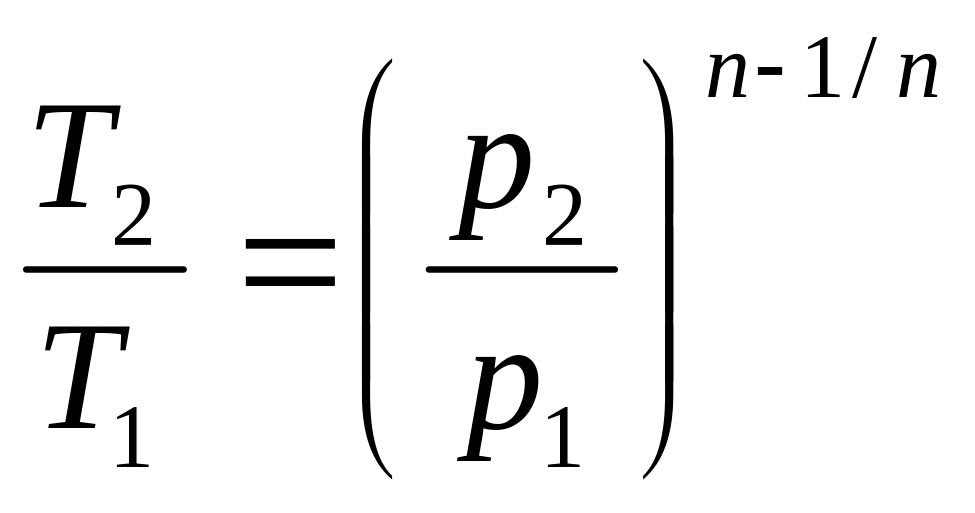 ,
,
На рис. 4.5 показано взаимное расположение на р, v- и Т, s-диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
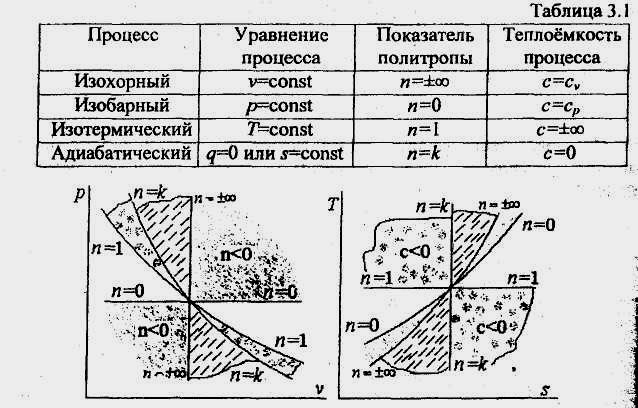 Изохора
(n=
± оо) делит поле диаграммы
на две области: процессы, находящиеся
правее изохоры, характеризуются
положительной работой, так как
сопровождаются расширением рабочего
тела; для процессов, расположенных левее
изохоры, характерна отрицательная
работа.
Изохора
(n=
± оо) делит поле диаграммы
на две области: процессы, находящиеся
правее изохоры, характеризуются
положительной работой, так как
сопровождаются расширением рабочего
тела; для процессов, расположенных левее
изохоры, характерна отрицательная
работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (n = 1), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как dq и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах |/|>|q!, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела
