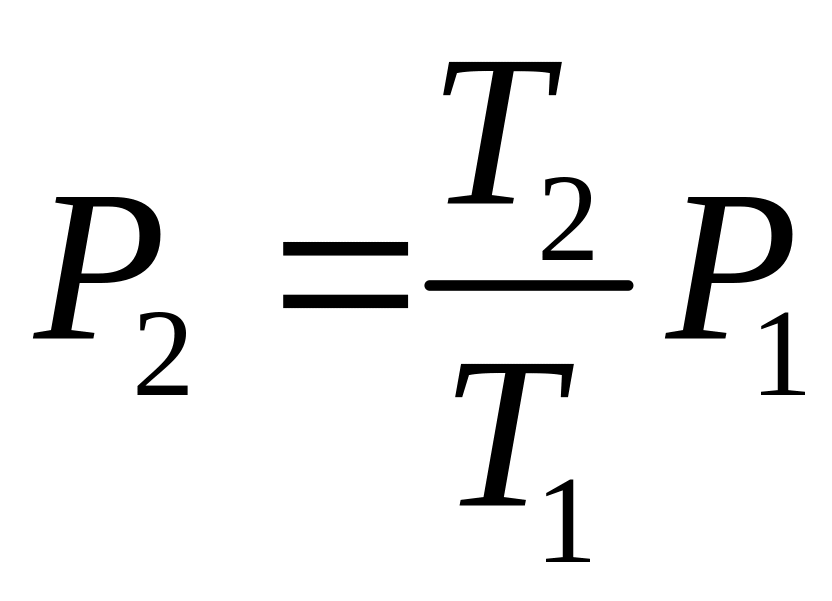- •Предмет физической химии
- •Структура физической химии
- •Основные понятия и определения Термодинамика
- •Термодинамическая система
- •Термодинамические параметры
- •Температура
- •Давление
- •Термодинамические функции
- •Свойства функций состояния
- •Термодинамический процесс
- •Смеси газов. Закон Дальтона
- •Мольная доля и парциальное давление
- •Законы реальных газов
- •Вопросы для самоконтроля
Термодинамический процесс
Термодинамический процесс – это изменение состояния термодинамической системы, которое сопровождается изменением хотя бы одного из параметров (давление, объем, температура) (рис. 1.10).
Термодинамические процессы классифицируют в зависимости от: постоянства одного из параметров, теплообмена, способности происходить самопроизвольно и достигать равновесия (рис. 1.11)
|
Рис. 1.10. Изменение параметров в термодинамическом процессе. |

Рис. 1.11. Классификация термодинамических процессов.
Законы идеальных газов
Закон Бойля
При постоянной температуре объем газа обратно пропорционален давлению (рис. 1.12).
V ~ 1/p, или:
pV = constant
I Закон Чарльза
Объем газа возрастает линейно с увеличением температуры вне зависимости от природы газа, при низком давлении (рис. 1.13.).
V = constant·(θ + 273 °C)
при T = constant
II Закон Чарльза
Давление газа, измеренное при постоянном объеме пропорционально изменению температуры (рис. 1.14.).
p = constant·T
(при V = constant)
Принцип Авогадро
Объем газа пропорционален количеству молекул (в молях), причем константа пропорциональности не зависит от природы газа (справедливо при постоянном объеме и температуре):
![]()
Объединенный газовый закон Менделеева-Клапейрона

Рис. 1.12. Иллюстрация закона Бойля. |
Рис. 1.13. Иллюстрация I закона Чарльза.
|
Рис. 1.14. Иллюстрация II закона Чарльза. |
R, газовая постоянная, в законе Менделеева-Клапейрона, в зависимости от единиц измерения термодинамических параметров, принимает различные значения (таблица 1.1.).
Таблица 1.1. Значение R
Значение R |
Единица измерения |
8.31451 |
Дж/К·моль |
8.20578·10-2 |
л·атм/К·моль |
8.31451·10-2 |
л·бар/К·моль |
8.31451 |
Па·м3/К·моль |
62.364 |
л·торр/К·моль |
1.98722 |
кал/К·моль |
Примеры решения задач Применение газовых законов Задача 1.1. В промышленном процессе азот нагревают до 500K в закрытом сосуде при постоянном объеме. Известно, что при температуре 300К давление в сосуде составляет 100 атм. Какое давление газа будет в сосуде при температуре 500К? Газ подчиняется законам идеальных газов. Данные для расчета:
Решение
Начальное состояние:
Отсюда следует:
В итоге получаем:
|





 .
Конечное состояние:
.
Конечное состояние:

 .
Поскольку
.
Поскольку
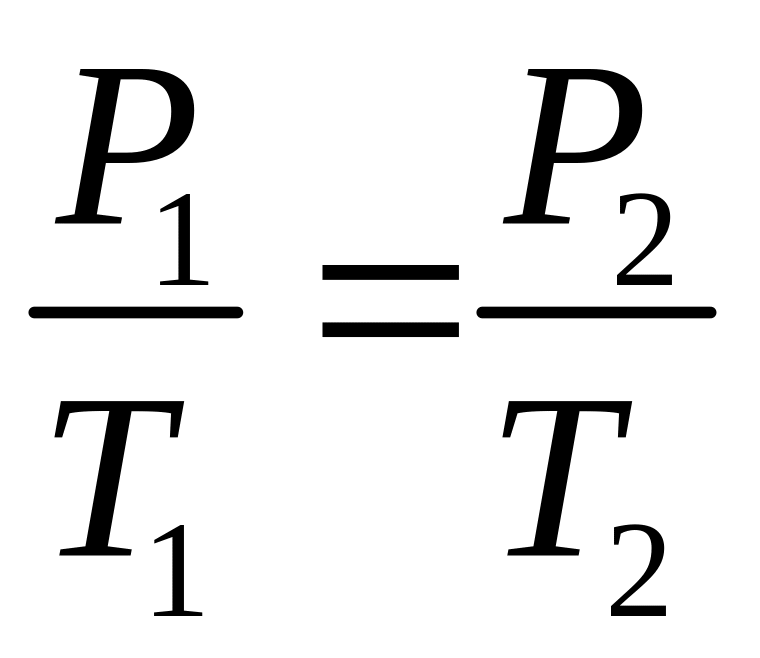 ,
,