
- •Предмет физической химии
- •Структура физической химии
- •Основные понятия и определения Термодинамика
- •Термодинамическая система
- •Термодинамические параметры
- •Температура
- •Давление
- •Термодинамические функции
- •Свойства функций состояния
- •Термодинамический процесс
- •Смеси газов. Закон Дальтона
- •Мольная доля и парциальное давление
- •Законы реальных газов
- •Вопросы для самоконтроля
1
Предмет физической химии 1
Структура физической химии 2
Основные понятия и определения 2
Термодинамика 2
Термодинамическая система 3
Термодинамические параметры 5
Температура 6
Давление 7
Термодинамические функции 7
Свойства функций состояния 8
Термодинамический процесс 8
Законы идеальных газов 9
Закон Бойля 9
I Закон Чарльза 9
II Закон Чарльза 9
Принцип Авогадро 9
Объединенный газовый закон Менделеева-Клапейрона 10
Смеси газов. Закон Дальтона 11
Мольная доля и парциальное давление 12
Законы реальных газов 14
Вопросы для самоконтроля 16
Предмет физической химии
Физическая химия – это наука о законах химических процессов и химических явлениях.
Законы и положения физической химии используются, чтобы объяснить и понять физические и химические свойства материи. Физическая химия объясняет явления, которые основаны на физических законах и дает количественное описание химических процессов.
Основная задача физической химии – это предсказание механизма и результата химического процесса, а также управление процессом для достижения наибольшей эффективности.
Современная физическая химия изучает:
химическую термодинамику, включая термохимию и учение о равновесиях, термодинамику растворов,
электрохимию,
химическую кинетику,
квантовую механику (строение вещества).
Теоретические основы физической химии являются фундаментом для проведения экспериментальных научных исследований и процессов в химической промышленности. (Рис. 0.1.).
Структура физической химии

Рис. 0.2. Структура физической химии
Основные понятия и определения Термодинамика
Термодинамика – это наука об использовании и превращениях энергии.
Химическая термодинамика использует законы и положения общей термодинамики к изучению химических явлений и физико-химических явлений: химических реакций. Фазовых переходов, процессов в растворах. В химической термодинамике для расчетов используют начальное и конечное состояние системы и внешние условия (параметры), известные из опыта.
Основные постулаты термодинамики
1. Система приходит в состояние равновесия при постоянных внешних условиях на границе с течением времени. (t → ∞). Иначе: любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из его выйти.
2. Все свойства термодинамической системы (включая внутренние параметры) – являются функцией внешних параметров и состава системы.
Выводы, которые делаются в физической химии на основании наблюдений и расчетов, обобщаются основными законами термодинамики (Рис. 0.3.).

Рис. 0.4.Основные законы термодинамики
Термодинамическая система
Объектом изучения термодинамики является термодинамическая система, которая находится во взаимодействии с окружающей средой (Рис. 0.5.).
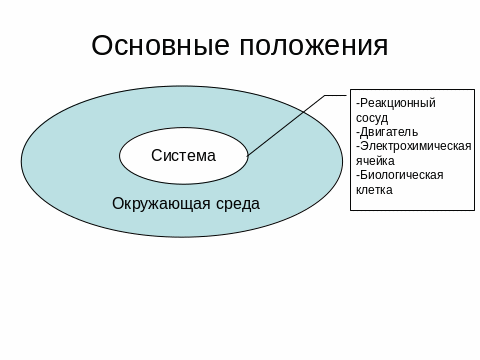
Рис. 0.6. Система и окружающая среда
Термодинамические системы подразделяют (Рис. 0.7.):
по типу обмена веществом и энергией с окружающей средой,
по количеству фаз в системе.

Рис. 0.8. Классификация термодинамических систем
По типу обмена веществом и энергией с окружающей средой термодинамические системы делятся на:
открытые,
закрытые,
изолированные (Рис. 0 .9).

Рис. 0.9. Типы термодинамических систем
Различают следующие состояния термодинамических систем:
равновесное (все характеристики системы постоянны и в ней нет потоков вещества и энергии)
устойчивое (стабильное) состояние (когда при бесконечно малом воздействии происходит бесконечно малое изменение систем, при устранении воздействия система приходит в исходное состояние)
метастабильное состояние (когда конечные воздействия на систему приводят к конечным изменениям, которые не исчезают при устранении этого воздействия)
неравновесное (устойчивое, лабильное) состояние, при котором бесконечно малые воздействия вызывают конечные изменения системы
стационарное, при котором независимые переменные постоянны во времени, но в системе имеются потоки.
При описании термодинамических систем важно знать количественный состав системы. В гомогенных однородных системах – это химический состав, в гетерогенных - химический и фазовый состав. Вещества, из которых состоит система называются составляющими. Некоторый минимальный набор составляющих веществ, достаточный для описания свойств системы называется независимыми составляющими или независимыми компонентами.
Состояния термодинамических систем описывают с помощью термодинамических переменных, которые делятся на независимые переменные (термодинамические параметры) и термодинамические функции.
