
- •Элементный анализ органических веществ
- •Опыт 1.3 Обнаружение азота по характерному запаху жженного органического вещества.
- •Аммиака.
- •По образованию осадка PbS.
- •(По окрашиванию пламени).
- •Алифатические углеводороды.
- •Арены и галогениды.
- •Спирты и фенолы
- •Гидроксидом меди (II).
- •Альдегиды и кетоны.
- •Сложные углеводы
- •Азотсодержащие соединения
- •Аминокислоты и белки
- •Сложные эфиры, жиры и мыла.
Азотсодержащие соединения
Дифениламин, ацетамид и мочевина кристаллические.
HNO3 конц., H2SO4 конц., 2 н NaOH, 2 н NH4OH, насыщ.
р-р Ba(OH)2, 10% NaNO2; 0,2 н CuSO4; 2 н NaNO3.
Водяная баня; спиртовка; предметные стекла.
Цель работы: сопоставить свойства азотсодержащих соединений, познакомиться с их качественными реакциями.
Опыт 9.1. Образование и гидролиз сернокислой соли
дифениламина (ДФА).
На предметное стекло поместите несколько кристаллов ДФА, а на них 2-3 капли H2SO4 конц.
С теклянной
палочкой размешайте кристаллы до их
растворения, т.е. образования соли
гидросульфата дифениламмония. С помощью
стеклянной палочки перенесите часть
раствора образовавшейся соли на другие
участки предметного стекла (см. рис.7.)для
проведения нескольких ка-
теклянной
палочкой размешайте кристаллы до их
растворения, т.е. образования соли
гидросульфата дифениламмония. С помощью
стеклянной палочки перенесите часть
раствора образовавшейся соли на другие
участки предметного стекла (см. рис.7.)для
проведения нескольких ка-
пельных проб.на предметном стекле:
Рис. 7. Капельные реакции ДФА
(а) гидролиз соли (оп.9.1.);
(б) реакция с HNO3 (оп.9.2.);
(в) реакция с NaNO3 (оп.9.2).
Добавьте на край одной из капель (другой палочкой ) каплю воды. В месте соприкосновения раствора соли и воды немедленно происходит гидролиз соли и выделение белого осадка свободного ДФА. Напишите реакции образования и гидролиза гидросульфата дифениламмония.
(Амины - органические основания. Анилин – (фениламин) –более слабое основание, чем алифатические амины: неподеленная пара электронов азота взаимодействует с сопряженной электронной системой бензольного ядра. Введение второй фенильной группы еще больше ослабляет основные свойства аммиака, ДФА образует соли только с концентрированными кислотами, а при разбавлении водой немедленно происходит гидролиз соли).
Опыт 9.2. Цветная реакция ДФА с HNO3 и нитратами.
Приготовить очень разбавленный раствор азотной кислоты: в пробирку 1 кап. HNO3 и долить водой почти до верха.
Одну каплю полученного разбавленного раствораHNO3 поместить на предметное стекло рядом с каплей сернокислого раствора ДФА. В месте соприкосновения капель (см. рис.7б) появляется интенсивное синее окрашивание.
Чтобы избежать гидролиза, - при проведении цветной реакции нужно
о с т е р е г а т ь с я и з б ы т к а в о д ы.
Дифениламин является реактивом на HNO3, т.к. при действии ее на раствор ДФА в конц. H2SO4 образуется темно-синего цвета аммониевая соль дифенилбензидина:
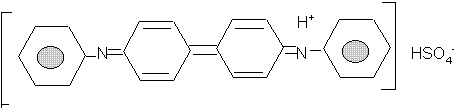
Интенсивная окраска вещества обусловлена наличием в молекуле системы сопряженных двойных связей.
Реакция используется для количественного колориметрического количественного определения концентрации HNO3.
Сделайте аналогичные пробы с растворами NaNO3, NaNO2, KMnO4.Эта реакция очень чувствительна и широко используется для санитарно-химического контроля загрязнения овощей нитратами, а рек – сточными водами.
Опыт 9.3. Щелочной гидролиз ацетамида.
Поместить в пробирку несколько кристаллов ацетамида, добавить 8 капель NaNO2 и 2 кап. конц. HNO3. Греть на спиртовке. Влажным красным лакмусом обнаружить аммиак.
Написать уравнение реакции.
Опыт 9.4. Дезаминирование ацетамида.
Поместить в пробирку несколько кристаллов ацетамида, добавит 2-3 капли NaNO2 и 2 капли конц. HNO3. Греть на спиртовке. С помощью влажного красного лакмуса убедиться в отсутствии аммиака в отходящем газе. Зафиксировать появление запаха уксусной кислоты.
Написать уравнение реакции.
Опыт 9.5. Растворимость мочевины в воде и образование ее
азотнокислой соли.
(а) В пробирку насыпать 1 лопаточку сухой мочевины, добавить 1 каплю Н2О (отметить очень хорошую растворимость мочевины в воде).
(б) к раствору мочевины добавить 2 капли конц. HNO3 и встряхнуть, - сразу или через несколько секунд начинается образование кристаллов азотнокислой мочевины ( реагирует мочевина с одной молекулой HNO3).
Написать уравнение реакции.
Кристаллы сохранить для следующего опыта.
Опыт 9.6. Дезаминирование мочевины.
К кристаллам азотнокислой соли мочевины (из оп. 9.5.) добавить 2-3 капли NаNO2 (написать уравнение реакции образования NaNO2). При встряхивании немедленно начинается выделение газа (СО2 и N2). С помощью влажного красного лакмуса убедиться, что здесь нет аммиака.
Написать уравнение.
Реакция разложения мочевины азотистой кислотой испльзуется для количественного определения мочевины по методу ван Слайка ( измеряется объем выделившегося азота).
Опыт 9.7. Гидролиз мочевины, доказательство ее строения.
 В
пробирку поместить 1 лопаточку мочевины
и добавить (не смачивая стенок пробирки)
6 капель Ba(OH)2.
Пробку закрыть не плотно и вставить
влажный красный лакмус ( рис.8). Греть
15-20 мин. на водяной бане. Объяснить
посинение лакмуса и появление мути в
пробирке.
В
пробирку поместить 1 лопаточку мочевины
и добавить (не смачивая стенок пробирки)
6 капель Ba(OH)2.
Пробку закрыть не плотно и вставить
влажный красный лакмус ( рис.8). Греть
15-20 мин. на водяной бане. Объяснить
посинение лакмуса и появление мути в
пробирке.
Написать уравнение реакции.
Рис.8
Опыт 9.8. Разложение мочевины при нагревании. Образование
биурета и циануровой кислоты. Биуретовая реакция.
В сухую пробирку поместить 2 лопаточки мочевины и осторожно нагревать (~ 5 см от пламени горелки). Сначала начинается плавление, затем выделение пузырьков газа, - аммиака, который можно зафиксировать по запаху и влажным красным лакмусом.
Вскоре выделение газа прекращается, а реакционная масса затвердевает вследствие образования биурета и циануровой кислоты. Разделить эти вещества можно, используя их различную растворимость в воде.
Пробирку о х л а д и т ь, добавить 10 капель Н2О и 2-3 мин.
к и п я т и т ь.
Легко растворимый биурет перейдет в раствор. Осадку циануровой кислоты дать отстояться, а раствор биурета слить в другую пробирку.
Опыт 9.8.1. К раствору биурета добавить 2-3 капли NаOH. При
этом исчезнет (если попала в раствор) муть от циануровой кислоты.
Добавить 1 каплю CuSO4, - появляется розово-фиолетовое
окрашивание комплексной соли меди, - биуретовая реакция (избытокCuSO4 вреден, т.к. маскирует характерную розовую окраску).
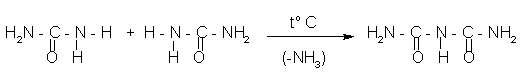
мочевина биурет
Название продукта – биурет – от латинских (by=два; urea=мочевина).
Биуретовая реакция является одной из главных качественных реакций на пептидную связь в пептидах и белках.

Опыт 9.8.2. К оставшемуся осадку циануровой кислоты добавить 2-
3 капли 2н NH4OH, энергично встряхнуть и добавить 1 каплю CuSO4.
Образуется с и р е н е в ы й о с а д о к комплексной медной соли циануровой кислоты.
Сама циануровая кислота – продукт взаимодействия трех молекул мочевины:

Мочевина Ц и а н у р о в а я к и с л о т а
(две таутомерные формы )
Объясните, почему циануровая кислота (“тримочевина”), не имеющая кислотной карбоксильной группы – СООН, является кислотой.
Лабораторная работа N10
