
- •Элементный анализ органических веществ
- •Опыт 1.3 Обнаружение азота по характерному запаху жженного органического вещества.
- •Аммиака.
- •По образованию осадка PbS.
- •(По окрашиванию пламени).
- •Алифатические углеводороды.
- •Арены и галогениды.
- •Спирты и фенолы
- •Гидроксидом меди (II).
- •Альдегиды и кетоны.
- •Сложные углеводы
- •Азотсодержащие соединения
- •Аминокислоты и белки
- •Сложные эфиры, жиры и мыла.
Спирты и фенолы
Э танол, пропанол-1, пропанол-2, бутанол-1,амиловый и изоамиловый одноатомные спирты;лицерин; фенол (жидкий)1; 1% резорцин; растворJ2 в KJ; 0,2н CuSO4; 2н NaOH; концентрированная H2SO4; 0,2 н FeCl3; NH4OH концентрированная; бромная вода; метилоранжевый индикатор; медная спираль; спиртовка; универсальная индикаторная
бумага.
Цель работы: сопоставить свойства спиртов и фенолов,
познакомиться с их качественными реакциями.
Опыт 4.1. Сравнение спиртов по их растворимости в воде и
по плотности.
В четыре пробирки прилить по 2-3 капли этанола, пропанола, бутилового и
изоамилового спиртов, а также по 5 капель Н2О; встряхнуть. То же проделать
с глицерином.
К смеси 1 мл изоамилового спирта и 1 мл Н2О добавить 1 каплю (J2 + KJ) и встряхнуть. Объясните изменения происходящие при этом в окраске водной и органической фаз. Приведите определение термина
“ экстракция”.
Сделайте выводы о физических свойствах спиртов (плотность, растворимость, запахи, качество растворителя).
Опыт 4.2. Получение диэтилового эфира (межмолекулярная
дегидратация этилового спирта).
В пробирку поместить кипятильные камни + 1 мл этилового спирта + 1 мл концентрированной H2SO4, нагреть до начала кипения. Прекратить нагрев и осторожно добавить 5 капель спирта. Встряхнуть и осторожно понюхать. Пробирку закрыть пробкой с газоотводной трубкой и снова нагреть. Поджечь газ у отверстия газоотводной трубки (обратите внимание на цвет пламени). Напишите уравнение реакции получения диэтилового эфира. Сравните условия меж- и внутримолекулярной дегидратации этанола ( см. получение этилена в лабораторной работе N 2).
Опыт 4.3.Окисление спиртов (пропанола и изопропанола) оксидом
меди(II).
Приготовить спираль из очищенной от изоляции медной проволоки (навить на стеклянную палочку h~ 2 см).
В две пробирки с пробками налить по 2 мл спиртов.
а) На пламени спиртовки раскалить спираль (до получения черного налета CuO) и горячую спираль быстро погрузить в пропанол-1; извлечь спираль и быстро закрыть пробирку пробкой. С целью накопления продукта процедуру повторить 4-5 раз.
б) Аналогично провести эксперимент с пропанолом-2. Сравнить запахи продуктов окисления обоих спиртов. Провести иодоформную пробу на ацетон (проба Либена) продуктов окисления обоих спиртов:
1 капля р-ра (J2+KJ) + 1 капля “Продукта“ (здесь “Продукт“ – результат окисления спирта). При наличии ацетона немедленно, без нагрева - выпадает осадок с характерным запахом иодоформа:
 J2
+ 2NaOH
NaOJ + NaJ +
H2O
J2
+ 2NaOH
NaOJ + NaJ +
H2O
Cравните результаты проб (а) и (б).
Иодоформная проба Либена очень чувствительна и обнаруживает ацетон в водных растворах уже при ~ 0,05%. (Сравните с опытом 3.5- получение иодоформа из спирта).
Опыт 4.4. Качественная реакция на многоатомные спирты с
Гидроксидом меди (II).
В пробирку прилить 5 капель CuSO4 + 5 капель NaOH + 3 капли глицерина.
Н аблюдать
внешний эффект реакции:
аблюдать
внешний эффект реакции:
Опыт 4.5. Качественные реакции на фенолы – (а) – с FeCl3,,
(б) – индофенольная проба..
Получить разбавленный прозрачный раствор фенола (1 капля жидкого фенола + 2 капли H2O).
а) В две пробирки прилить по 1 капле: в 1-ю – фенола, во 2-ю – резорцина.
В каждую пробирку добавить по 1 капле FeCl3, - сравнить окраски. При добавлении 1 капли HCl окраска исчезает.
Напишите реакции образования Fe – комплексов с фенолом и резорцином.
б) Индофенольная проба на фенолы – еще более чувствительна:
в пробирку прилить 1 каплю фенола + 3 капли NH4OH + 3 капли Br2.
Через несколько секунд появляется синее окрашивание, постепенно усиливающееся за счет образования индофенола:

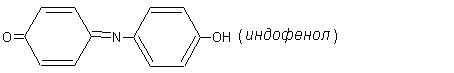 Интенсивная
окраска обусловлена образованием в
молекуле индофенола хиноидной группировки.
Интенсивная
окраска обусловлена образованием в
молекуле индофенола хиноидной группировки.
Опыт 4.6. Доказательство кислотного характера фенолов.
(а) Универсальным индикатором определить рН растворов фенола и резорцина.
(б) В пробирку прилить 1 каплю “ жидкого фенола” и 5 капель Н2О (встряхнуть). К полученной эмульсии фенола добавить 2 капли NaOH, - получается раствор фенолята натрия. К раствору фенолята добавить 2 капли HCl, - раствор мутнеет вследствие выделения свободного фенола. Написать уравнения реакций.
Опыт 4.7. Бромирование фенолов.
В две пробирки поместить по 3 капли Br2 и по 1 капле фенола
(в первую) и резорцина (во вторую). Наблюдать образование осадков трибромфенолов и обесцвечивание бромной воды. Написать уравнения реакций.
Для опытов 4.6. и 4.7. сделать общий вывод о взаимном влиянии атомов в молекуле фенола.
Лабораторная работа N 5.
