
- •Элементный анализ органических веществ
- •Опыт 1.3 Обнаружение азота по характерному запаху жженного органического вещества.
- •Аммиака.
- •По образованию осадка PbS.
- •(По окрашиванию пламени).
- •Алифатические углеводороды.
- •Арены и галогениды.
- •Спирты и фенолы
- •Гидроксидом меди (II).
- •Альдегиды и кетоны.
- •Сложные углеводы
- •Азотсодержащие соединения
- •Аминокислоты и белки
- •Сложные эфиры, жиры и мыла.
Арены и галогениды.
Бензол; толуол ; ксилол ; 2% р-р Br2 в CCl4;
NaCl крист.; р-р J2 в KJ; C6H5Cl; C6H5 –CH2-Cl ;
0,1 н AgNО3; 2 н H2SO4; конц. H2SO4; конц. HNO3;
2н NaOH; C2H5OH; 2 н HCl; натронная известь; мик-.
роскоп; спиртовка; предметное стекло.
Цель работы: 1).Сопоставить химические свойства бензола и его гомологов. 2) Познакомиться с некоторыми методами получения галогенидов
и их свойствами.
Опыт 3.1. Получение бензола из бензоата натрия
В пробирку (а) поместить смесь равных по массе частей
C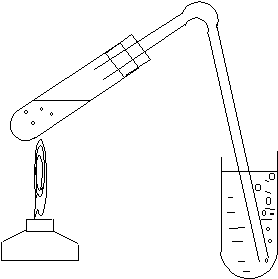 6H5COONa
и натронной извести (h~ 5
мм) и закрыть ее пробкой с короткой
газоотводной трубкой (схема установки
- на рис.1 из лабораторной работы N
1). Конец трубки поместить в маленькую
пробирку с нитрующей смесью ( 3 капли
HNO3 конц. + 3 капли
конц. H2SO4).
Греть пробирку (а): сначала прогреть ее
верхнюю часть для предотвращения
конденсации паров бензола, а затем
нижнюю ее часть (рис. 3).
6H5COONa
и натронной извести (h~ 5
мм) и закрыть ее пробкой с короткой
газоотводной трубкой (схема установки
- на рис.1 из лабораторной работы N
1). Конец трубки поместить в маленькую
пробирку с нитрующей смесью ( 3 капли
HNO3 конц. + 3 капли
конц. H2SO4).
Греть пробирку (а): сначала прогреть ее
верхнюю часть для предотвращения
конденсации паров бензола, а затем
нижнюю ее часть (рис. 3).
Через несколько секунд в пробирке (б) над слоем кислот появляется темная капля нитробензола. Извлеч трубку из нитрующей смеси и прекратить нагрев.
Рис.3. Схема получения
бензола и его нитрования.
В пробирку (б) добавить 8-10 капель H2O, чтобы разбавить кислоты, взболтать содержимое пробирки и определить наличие нитробензола по характерному запаху (запах горького миндаля).
Обратить внимание на плотность нитробензола (положение его капли до и после разбавления кислот водой).
Открыть пробирку (а) и сравнить запах ее содержимого с запахом готового бензола. В охлажденную пробирку (а) добавить раствор HCl. Объяснить причину выделения CO2.
Написать реакции: (1) образования бензола; (2) нитрования (В); (3) разложения Na2CO3 кислотой HCl.
Примеч.: реакция перевода бензола (имеет слабый запах) в нитробензол (имеет специфический запах) используется для обнаружения паров бензола ( и его гомологов) в воздухе цехов предприятий в целях ТБ.
Опыт 3.2. Бромирование аренов.
В три сухие пробирки поместить по 1 мл бензола, толуола и ксилола и прилить по 10 капель Br2. Разделить каждую смесь на три части, отделив половину ее объема в другую сухую пробирку (теперь их – 6). Одну часть каждой смеси оставить в штативе, вторую – греть до кипения.
Сравнить скорости бромирования бензола, толуола и ксилола на холоду и при нагреве. Написать уравнения реакций.
Опыт 3.3. Окисляемость аренов.
В три пробирки поместить по 5 капель бензола, толуола и ксилола и добавить по 1мл KMnO4 и по 1 мл 2 н H2SO4.
Пробирки слегка нагреть (до 50-600 С), затем энергично встряхнуть их содержимое. Наблюдать изменение окраски KMnO4.
Сделать выводы и написать реакции окисления толуола и ксилола.
Опыт 3.4. Сравнение прочности связи галогена в бензольном кольце
и в боковой цепи.
(а) 1 каплю С6Н5Сl + 5капель Н2О
(б) 1 каплю С6Н5 -СН2- Сl + 5капель Н2О
Пробирки нагреть до кипения и к горячему р-ру доб. 1 каплю AgNO3 .
Сравнить и объяснить результаты.
Примеч.: Появление после охлаждения пробирки (а) мути обусловлено резким ухудшением растворимости в воде С6Н5Сl. При повторном нагреве помутнение исчезает, при охлаждении – появляется вновь.
Опыт 3.5. Получение иодоформа из этилового спирта.
 К
1 капле С2Н5ОН прилить 3 капли
(J2 + KJ)
и 3 капли NaOH. Уже при слабом
нагреве (даже от тепла руки) появляется
белая муть с очень характерным стойким
запахом иодоформа (качественная реакций
на этанол):
К
1 капле С2Н5ОН прилить 3 капли
(J2 + KJ)
и 3 капли NaOH. Уже при слабом
нагреве (даже от тепла руки) появляется
белая муть с очень характерным стойким
запахом иодоформа (качественная реакций
на этанол):
В ыделяющийся
при разложении NaOJ атомарный
кислород окисляет этанол до уксусного
альдегида:
ыделяющийся
при разложении NaOJ атомарный
кислород окисляет этанол до уксусного
альдегида:
П одвижные
атомы водорода метильной группы альдегида
легко замещаются атомами иода:
одвижные
атомы водорода метильной группы альдегида
легко замещаются атомами иода:
Щ елочь,
в свою очередь, отщепляет от иодаля
альдегидную группу:
елочь,
в свою очередь, отщепляет от иодаля
альдегидную группу:
Нагревать смесь иода со спиртом и щелочью, а тем более к и п я т и т ь
н е л ь з я, т.к. образующийся иодоформ разлагается щелочью, а появившаяся желтая муть иодоформа – исчезает.
Если муть растворилась, - добавить к теплому раствору еще 3-5 капель (J2 + KJ) и подождать 3-5 минут, пока кристаллы сформируются.
Пипеткой взять со дна пробирки 2 капли осадка и перенести их на предметное стекло. См. кристаллы под микроскопом ( зарисо-вать их форму).
Примеч.: реакция образования иодоформа используется в судмедэкспертизе для обнаружения этилового спирта.
Опыт 3.6. Получение хлористого этила из этанола.
В пробирку насыпать NaCl крист. (h~3 мм), добавить 4 капли С2Н5ОН (смочить соль). Затем добавить 3 капли концентрированной
H2SO4.
 Осторожно
нагреть. Время от времени поджигать
выделяющийся из пробирки хлорэтил, - он
горит, образуя характерное колечко
зеленого цвета. Как только будет замечено
слабое зеленое колечко, - поставить
пробирку в штатив, прекратить нагрев.
Через 10 мин нагреть пробирку и поджечь
хлорэтил. Не нюхать!
Параллельно выделяется HCl:
Осторожно
нагреть. Время от времени поджигать
выделяющийся из пробирки хлорэтил, - он
горит, образуя характерное колечко
зеленого цвета. Как только будет замечено
слабое зеленое колечко, - поставить
пробирку в штатив, прекратить нагрев.
Через 10 мин нагреть пробирку и поджечь
хлорэтил. Не нюхать!
Параллельно выделяется HCl:
Напишите суммарную реакцию С2Н5ОН с HCl.
Лабораторная работа N4
