Виды гибридизации
В
методе валентных связей для предсказания
геометрического строения молекул типа
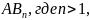 и
значений валентных углов применяют
идею гибридизации атомных орбиталей
(АО).
и
значений валентных углов применяют
идею гибридизации атомных орбиталей
(АО).
Гибридизация – это выравнивание (усреднение) энергии у атома А различных атомных орбиталей в результате смешения (гибридизации) перед химическим воздействием (или в процессе), что приводит к образованию гибридных орбиталей, направленных в сторону образующейся связи.
Гибридизация не является реальным физическим явлением. Она представляет собой условный прием, позволяющий предсказать структуру молекулы при помощи комбинации АО.
В гибридизации могут участвовать только те АО, энергии которых достаточно близки; например, 1s – атомные орбитали не участвуют в образовании 2s- и 2p-атомных орбиталей. В результате гибридизации энергии атомных орбиталей с разным значением орбитального квантового числа l выравниваются, что приводит к образованию равноценных σ- связей. Длина и энергия всех связей в молекуле А-В становятся равными.
В гибридизации могут участвовать вакантные АО, орбитали с неспаренными электронами и неподеленными электронными парами. Атомные орбитали, не имевшие электронов в основном состоянии атома либо ставшие вакантными при перераспределении электронов в процессе образования молекулы, могут не участвовать в гибридизации, если для них не хватает σ- активных электронных пар. Такие АО приобретают другое значение энергии и частично или полностью включаются в образование делокализованных π-связей.
В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов электронные пары оказались максимально удаленными друг от друга. Такое состояние молекулы будет отвечать минимуму энергии межэлектронного отталкивания.
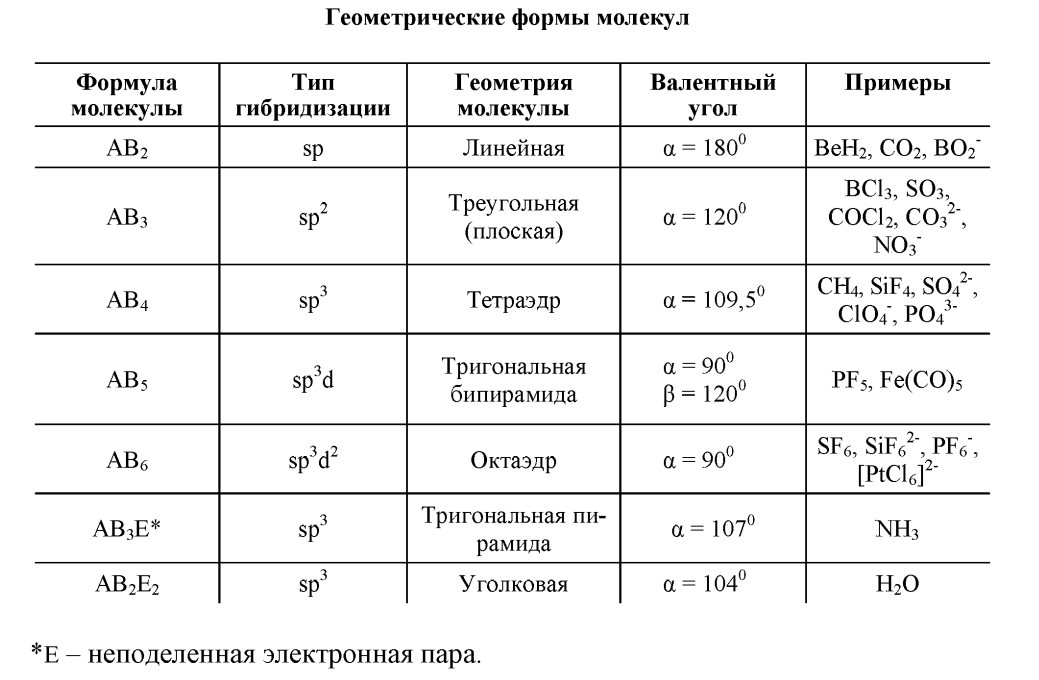
Каждому виду гибридизации АО соответствует определенная геометрическая форма молекулы, образованная σ-связями, создающими жесткий скелет частицы, в электростатическом поле которого, в случае кратных связей движутся делокализованные пары π- электронов.
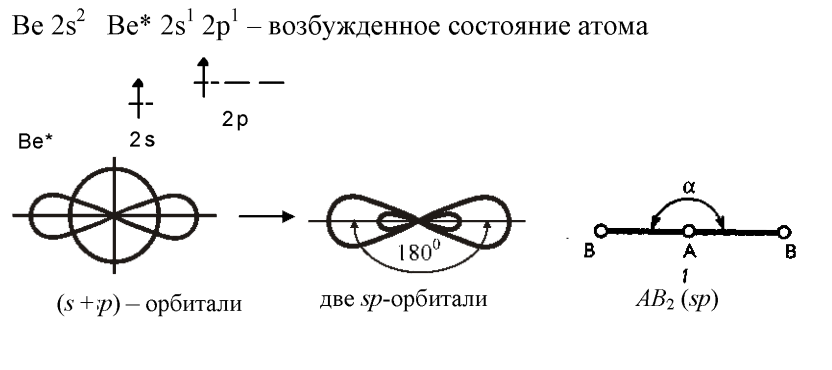
sp-гибридизация.
Подобный тип гибридизации возникает
при образовании атомов двух связей за
счет электронов, находящихся на s-
и p-
орбиталях и обладающих близкой энергией.
Этот тип гибридизации характерен для
молекул типа
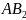 .
Например, рассмотрим структуру молекулы
.
Например, рассмотрим структуру молекулы
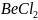 .
Атом бериллия имеет в нормальном
состоянии во внешнем слое два спаренных
s-
электрона. В результате возбуждения
один из s-
электронов переходит в p-
состояние – появляются два неспаренных
электрона, отличающиеся формой орбитали
и энергией. При образовании химической
связи они преобразуются в две одинаковые
sp-гибридные
орбитали, направленные под углом
.
Атом бериллия имеет в нормальном
состоянии во внешнем слое два спаренных
s-
электрона. В результате возбуждения
один из s-
электронов переходит в p-
состояние – появляются два неспаренных
электрона, отличающиеся формой орбитали
и энергией. При образовании химической
связи они преобразуются в две одинаковые
sp-гибридные
орбитали, направленные под углом
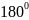 друг к другу.
друг к другу.
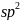 -гибридизация.
Этот
тип гибридизации имеет место в частицах
состава
-гибридизация.
Этот
тип гибридизации имеет место в частицах
состава
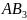 .
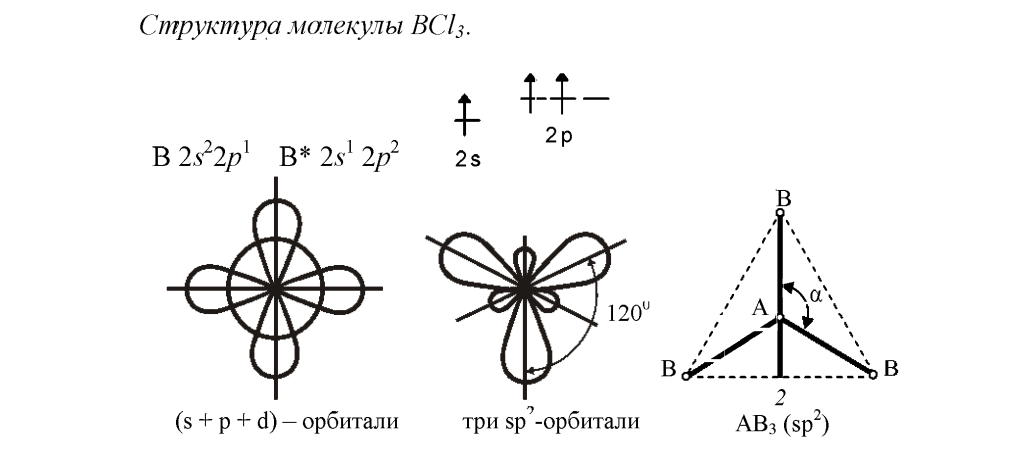
Комбинация трех орбиталей – одной s-
и двух p-
типа приводит к образованию трех
-
гибридных орбиталей, расположенных в
одной плоскости под углом
.
Комбинация трех орбиталей – одной s-
и двух p-
типа приводит к образованию трех
-
гибридных орбиталей, расположенных в
одной плоскости под углом
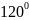 .
Под таким углом располагаются и σ связи,
образованные с участием электронов
этих орбиталей. Форма молекул и ионов
– треугольная (плоская).
.
Под таким углом располагаются и σ связи,
образованные с участием электронов
этих орбиталей. Форма молекул и ионов
– треугольная (плоская).
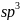 -
гибридизация
. Гибридизация одной s-
и трех p-
орбиталей характерна для частиц состава
-
гибридизация
. Гибридизация одной s-
и трех p-
орбиталей характерна для частиц состава
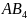 .
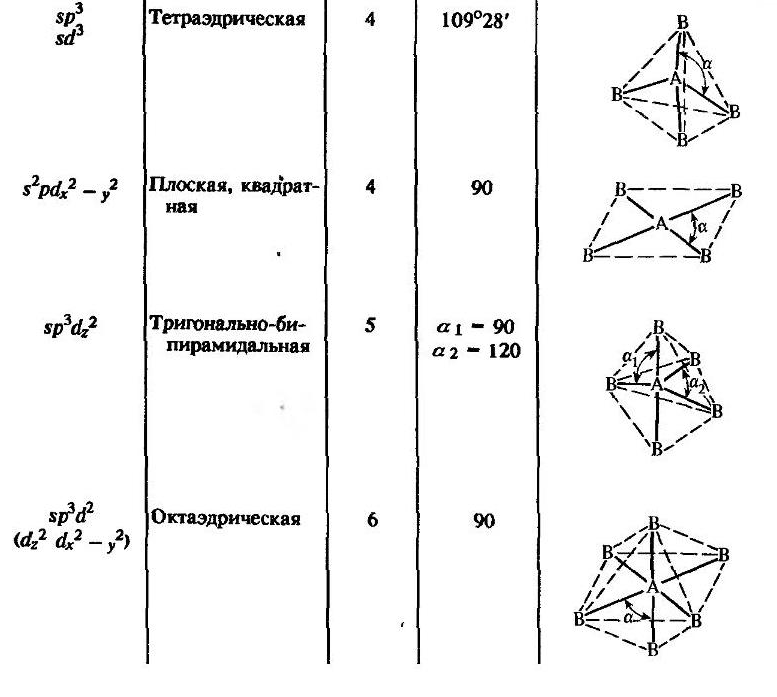
Комбинация четырех орбиталей – одной
s-
и трех p-типа
– приводит к
-
гибридизации, при которой четыре
гибридные орбитали симметрично
ориентированы в пространстве под углом
.
Комбинация четырех орбиталей – одной
s-
и трех p-типа
– приводит к
-
гибридизации, при которой четыре
гибридные орбитали симметрично
ориентированы в пространстве под углом
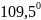 к четырем вершинам тетраэдра.
к четырем вершинам тетраэдра.
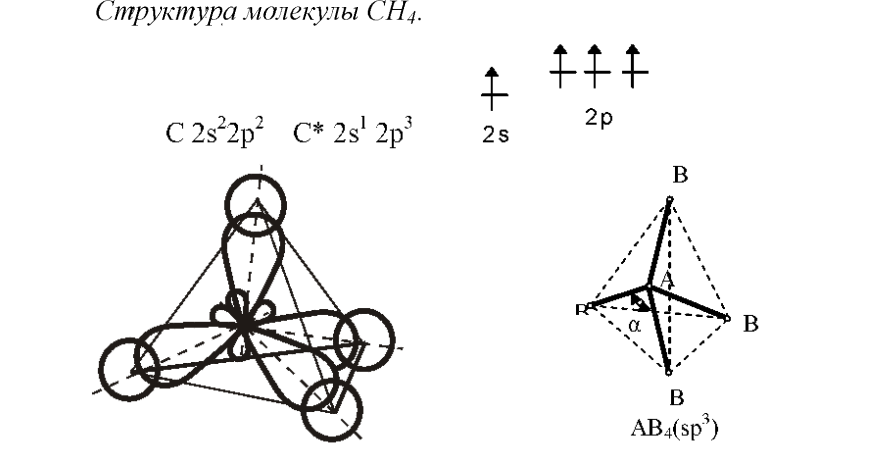
При
наличии одной или нескольких гибридных
орбиталей с парой электронов или с
неспаренным электроном геометрическая
форма называется незавершенной. Например,
рассмотрим строение молекулы
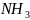 .
У атома азота на четырех гибридные
орбитали приходится пять электронов.
.
У атома азота на четырех гибридные
орбитали приходится пять электронов.
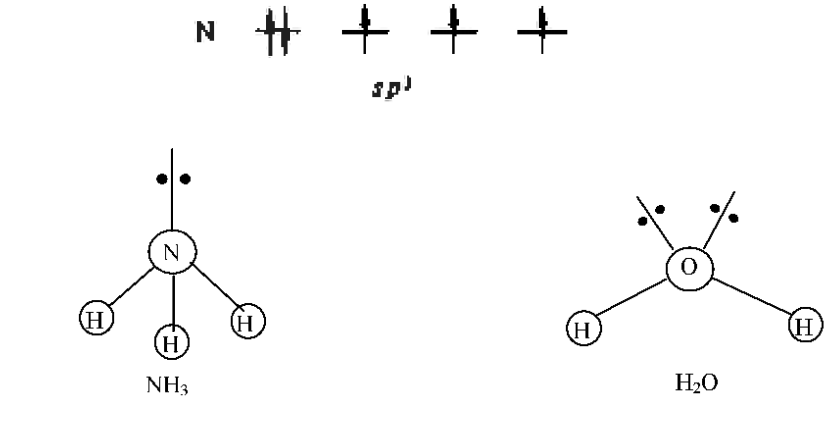
Следовательно, одна пара жлектронов оказывается несвязывающей и занимает одну из - гибридных орбиталей, направленных к вершине тетраэдра. Молекула имеет форму тригональной пирамиды.
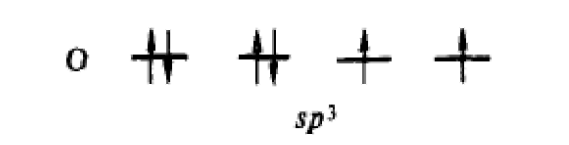
У
атома кислорода на четыре
-
гибридные орбитали приходится шесть
электронов: две навязывающие электронные
пары занимают две гибридные
-
орбитали. Молекула
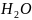 имеет угловую форму.
имеет угловую форму.
Форму описанных выше молекул можно объсянить с позицией модели взаимного отталкивания электронных пар (Гиллеспи). Согласно этой теории неподеленная электронная пара занимает больший объём, чем поделенная и потому отталкивание при наличии таких пар проявляется в большей степени, что и приводит к снижению валентного угла, особенно в случае молекулы воды.
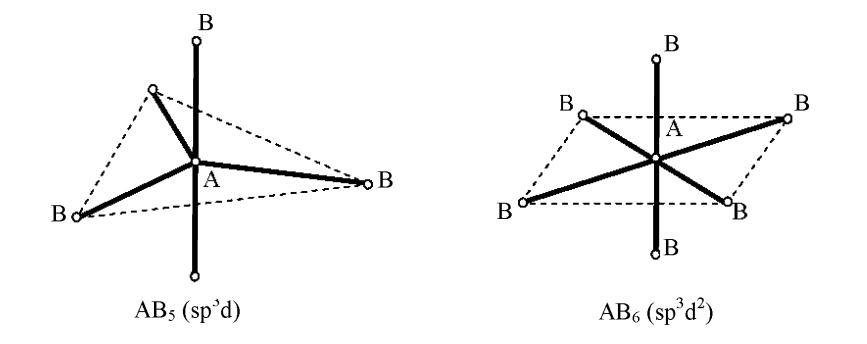
В
гибридизации кроме s-
и p-
могут участвовать и d-
орбитали, которые, выравниваясь по форме
и энергии с s-
и p-
электронными облаками, приобретают
напрвленность в пространстве к вершинам
тригональной бипирамиды или октаэдра.
В этих случаях в образовании σ-связей
участвуют гибридные
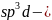
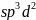 -
орбитали для частиц состава
-
орбитали для частиц состава
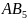 ( например,
( например,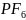 ) и
) и
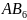 (
(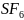 ).
).
В
первом случае форма молекулы –
тригонально-бипирамидальная (α=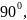 β=
),
во втором – октаэдрическая (α
β=
),
во втором – октаэдрическая (α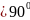 ).
).