
Федеральное агентство по образованию
ГОУ ВПО «Уральский государственный технический университет - УПИ»
Кафедра физической и коллоидной химии
Жукова Лия Васильевна
Дополнение к сборнику задач «Термодинамическое исследование фазовых состояний двухкомпонентных систем (галогенидов металлов)»
по дисциплине «Технология материалов и оборудования для производства монокристаллов, материалов и изделий электронной техники» для студентов всех форм обучения специальности 251000 – Химическая технология монокристаллов, материалов и изделий электронной техники
Екатеринбург 2007
Задача №1
Используя изобарическую диаграмму состояния Т─ N2 или Т─ φ2 системы
AgCl-AgBr выполните следующие задания:
Охарактеризуйте взаимную растворимость компонентов, составляющих
систему, в жидком и твердом состояниях.
Опишите влияние на температуру начала кристаллизации и температуру
плавления концентрации 2-го компонента в системе.
Отметьте особые точки на диаграмме, определите число фаз и их состав,
рассчитайте вариантность системы в этих точках.
Укажите число фаз и их состав в системе с концентрацией 2-го компонента
равной а=55%, в=70%, с=97% при температурах Т1 = 500°С и Т2 = 415°С.
Схематично изобразите кривые охлаждения для системы с концентрациями
2-го компонента, равными а=55%, в=70%, c=97%. Рассчитайте вариантность системы на разных участках кривых охлаждения.
6. Для расплава, содержащего m1 кг 1-го компонента и m2 кг 2-го компонента, найдите температуру начала и конца кристаллизации. Рассчитайте массы равновесных фаз в этой системе при температуре Т2 = 415°С.

Решение:
Компоненты, составляющие систему, неограниченно растворимы в
твердом и жидком состояниях.
2. Температура начала кристаллизации Тн.к. уменьшается с ростом φ2 до точки А
(точка минимума), и возрастает после этой точки. Такая же зависимость наблюдается для температуры плавления.
т.А: f=2+2-2-(1+1)=0 ,
т.к. L=2: р-соnst и N2(ж) = N2(тв)
f= K+(C-r)-Ф-L
K=2 (T,p)
r=0 (отсутствуют химические реакции)
L=1 (p-const)
F=2+C-Ф-1=1+С-Ф
т.1(Т=455°С):
f=2+1-1-1=1,
т.к. С=1 (чистый компонент)
Т1 = 500°С:
а=55% Ф=1(ж)
в=70% Ф=1(ж)
с=97% Ф=1(ж)
Т2 = 415°С:
а=55% Ф=1(тв)
в=70% Ф=1(ж)
с=97% Ф=1(тв)
Кривые охлаждения для
а=55%
в=70%
с=97%
m1 = 0,5кг
m2 =0,61 кг
Найти: Тн.к. , Тк.к.
φ2 =
![]() (55%)
(55%)
Тн.к. = 420°С
Тк.к. = 416°С
Найти массы равновесных фаз в этой системе при Т=417°С

т.к.

![]() кг
кг

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() кг
кг
![]() кг
кг
Задача №2
Проанализировать изобарическую диаграмму состояния Т-N2 системы AgCl-AgJ. Охарактеризовать взаимную растворимость компонентов в жидком и твердом состоянии, ее зависимость от N2. Описать отдельные области на этой диаграмме (сколько фаз, какие), линии (название, какую зависимость выражают) и характерные точки.
Проследить за изменением состояния системы с N2 = 37,5% и N2 = 90% от Т1=550°С до Т2=175°С. Какие фазы находятся в равновесии, какова вариантность при Т= Т1? Как измениться число фаз, их состав и вариантность системы при изменении температуры до Т2?
Определить, сколько фаз имеет система с N2 =75% при Т= Т2. При какой температуре начинается ее плавление? Каков состав первых капель жидкости? При какой температуре система полностью расплавится?
Рассчитать массы фаз, находящихся в равновесии в системе с N2 = 10% при Т=175°С, при общей массе системы 1 кг. Рассчитать массу 2-го компонента в каждой фазе.
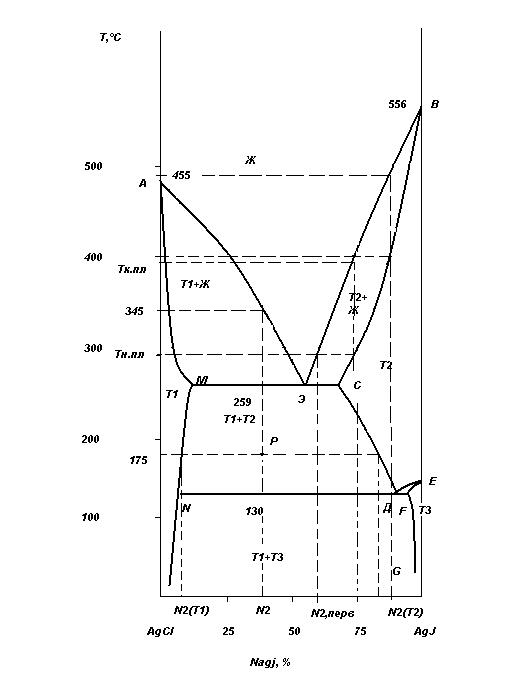
Решение:
В жидком состоянии компоненты обладают неограниченной взаимной
растворимостью. В твердом состоянии – ограниченной растворимостью, с образованием твердых растворов. При низких значениях N2 образуются твердые растворы, обогащенные компонентом (1); при высоких значениях N2 образуются твердые растворы, обогащенные компонентом (2).
Области:
ж – жидкая фаза;
Т1 - твердый раствор 2-го компонента в 1-м;
Т2 - твердый раствор 1-го компонента во 2-м, 2-й компонент находиться в α- модификации;
Т3 – твердый раствор 1-го компонента во 2-м, 2-й компонент находиться в β- модификации;
АЭВ – линия ликвидуса.
Т(N2(ж)) – зависимость температуры начала кристаллизации от состава жидкой фазы.
ВСДЕ – линия солидуса.
Т(N2(т)) - зависимость температуры конца кристаллизации от N2 в Т2.
Аналогично:
EFG: T=f (N2(T3))
AMN: T=f (N2(T1))
Точки:
Э: в равновесии находятся 3 фазы: ж, Т1иТ2;
Д: в равновесии находятся 3 фазы:Т2,Т3 и Т1;
А: в равновесии находятся AgCl (тв ) и AgCl (ж);
В: α- AgJ (тв) и β- AgJ (ж);
Е: переход от α-модификации к β- модификации AgJ.
а) N2 = 37,5% от Т1=550°С до Т2=175°С
● 550° ÷ 345°С Ф=1 (ж)
f = K+C – r ─ Ф – L = 2+2-0-Ф-1=3-Ф
f = 3-1=2
● 345° ÷ 259°С Ф=2 (Т1 и ж), f =3-2=1
● 259° ÷ 175°С Ф=2 (Т1и Т2), f = 3-2=1
б) N2 = 90% от Т1=550°С до Т2=175°С
● 550° ÷ 475°С Ф=1 (ж), f =2
● 475° ÷ 400°С Ф=2 (Т2 и ж), f =1
● 400° ÷ 175°С Ф=1 (Т2), f =2
N2 =75% Т2=175°С
Число фаз Ф=2 (Т1 и Т2)
Начало плавления Тн.пл.=300°С
Конец плавления Тк.пл.=385°С
Состав первых капель жидкости N2,перв(ж)=62%
4. Дано: N2 =75%
Т2=175°С (точка Р)
m = 1 кг
Найти
![]() ─ ?
─ ?
![]() ─ ?
─ ?
Решение:
1)
![]()


2)

