
- •Семинар № 4 «Потенциометрические методы анализа. Метод прямой потенциометрии»
- •Потенциометрические методы анализа: сущность и классификация
- •Электродный потенциал. Уравнение Нернста
- •Установка для потенциометрических измерений – электрохимическая ячейка
- •Индикаторные электроды
- •Редокс-электроды;
- •Металлические электроды I рода
- •Металлические электроды II рода
- •Редокс-электроды
- •Пленочные электроды
- •Электроды сравнения
- •Стандартный водородный электрод
- •Хлоридсеребряный (хлорсеребряный) электрод
- •Каломельный электрод
- •Метод прямой потенциометрии. Основные приемы ионометрического анализа
- •Метод градуировки электрода (метод стандартов);
- •Метод градуировочного (калибровочного) графика;
- •Метод добавок.
- •Метод градуировки электрода (метод стандартов)
- •Метод градуировочного (калибровочного) графика
- •Метод добавок
Каломельный электрод
Каломельный электрод сравнения состоит из металлической ртути, каломели и раствора хлорида калия (рис. 4).
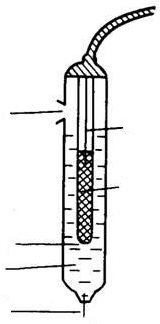

Рис. 4. Каломельный электрод сравнения:
1 – платиновая проволока, 2 – асбестовое волокно, обеспечивающее контакт с анализируемым раствором, 3 – внешний насыщенный раствор KCl, 4 – отверстие для контакта, 5 – отверстие для ввода раствора KCl, 6 – паста из смеси Hg2Cl2, Hg, KCl (насыщ.)
В основе работы каломельного электрода лежит полуреакция:
Hg2Cl2 (тв) + 2e- ↔ 2Hg + 2Cl-
Его потенциал зависит от концентрации (активности) хлорид-ионов в растворе:

Известны 0,1 М, 1 М и насыщенный каломельные электроды в зависимости от концентрации раствора хлорида калия, контактирующего с пастой из металлической ртути и каломели. Серийно выпускается насыщенный каломельный электрод, имеющий при 250С потенциал равный (0,247±0,001) В (относительно СВЭ).
Потенциал каломельного электрода сравнения изучен при различных концентрационных и температурных условиях и его величины по отношению к СВЭ хорошо известны. Стандартный потенциал каломельного электрода при различных температурах может быть рассчитан по уравнению:

Метод прямой потенциометрии. Основные приемы ионометрического анализа
Методы прямой потенциометрии (ионометрии) основаны на непосредственном применении уравнения Нернста для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу электрода.
Наибольшее распространение среди прямых потенциометрических методов получил метод определения рН при помощи стеклянного электрода, хотя создание в последнее время надежно работающих ионселективных электродов значительно расширило практические возможности прямых методов. Прямые потенциометрические методы, в которых в качестве индикаторных используются ионселективные электроды, называют ионометрическими методами анализа или ионометрией. Это удобный, простой и экспрессный современный метод анализа: его продолжительность определяется временем подготовки пробы, так как на само измерение тратится не более 1-2 минут. От других ФХМА ионометрия отличается, прежде всего, простотой методик и дешевизной измерительных приборов. Современные портативные иономеры позволяют определять разнообразные ионы и растворенные газы не только в лаборатории, но и в полевых условиях.
Эта группа методов интенсивно развивается в связи с успехами в конструировании и улучшении качества ионселективных электродов, позволяющих проводить быстрее и точнее определение концентрации или активности ионов и обладающих рядом других достоинств.
Уравнение для метода прямой потенциометрии, связывающее величину измеренного потенциала электрода Е и показатель активности ионов в растворе рА, можно получить из выражений

и
 ,
,
где Е – измеренный потенциал, Еср – потенциал электрода сравнения, Еj – диффузионный потенциал, S – угловой коэффициент (крутизна) электродной реакции, равный 0,059/zA (250C).
Решая систему уравнений, получаем:

Здесь К´ включает в себя const, Еср и неизвестную величину Еj, поэтому нужно либо оценить, либо исключить К´.
Существуют три практических приема прямого потенциометрического определения содержания ионов в растворе:
