
- •Семинар № 4 «Потенциометрические методы анализа. Метод прямой потенциометрии»
- •Потенциометрические методы анализа: сущность и классификация
- •Электродный потенциал. Уравнение Нернста
- •Установка для потенциометрических измерений – электрохимическая ячейка
- •Индикаторные электроды
- •Редокс-электроды;
- •Металлические электроды I рода
- •Металлические электроды II рода
- •Редокс-электроды
- •Пленочные электроды
- •Электроды сравнения
- •Стандартный водородный электрод
- •Хлоридсеребряный (хлорсеребряный) электрод
- •Каломельный электрод
- •Метод прямой потенциометрии. Основные приемы ионометрического анализа
- •Метод градуировки электрода (метод стандартов);
- •Метод градуировочного (калибровочного) графика;
- •Метод добавок.
- •Метод градуировки электрода (метод стандартов)
- •Метод градуировочного (калибровочного) графика
- •Метод добавок
Стандартный водородный электрод
Универсальным электродом сравнения является стандартный водородный электрод (рис. 2).
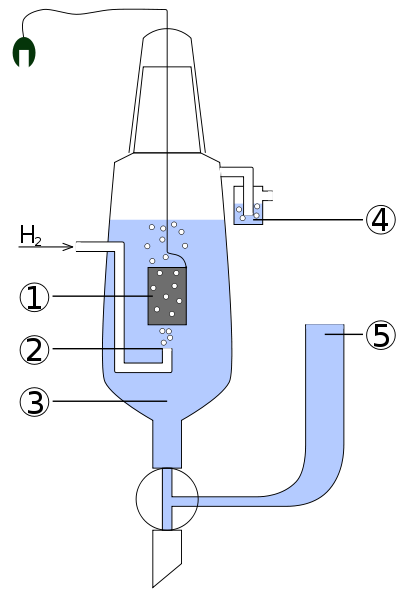
Рис. 2. Стандартный водородный электрод:
1 – платиновый электрод, 2 – подводимый газообразный водород, 3 – раствор обычно соляной кислоты, 4 – водяной затвор, препятствующий попаданию кислорода воздуха, 5 – электролитический мост, позволяющий присоединить вторую половину гальванического элемента
Стандартный водородный электрод (СВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластинки зависит от концентрации ионов водорода в растворе. При давлении водорода равном 1 атм., активности ионов водорода равной 1 и температуре Т=298,15 К потенциал стандартного водородного электрода принят равным нулю. При сборке гальванического элемента из СВЭ и данного индикаторного электрода на поверхности платины обратимо протекает электродный процесс
2Н+ + 2е- ↔ Н2 ↑,
то есть протекает реакция либо восстановления водорода, либо его окисления в зависимости от потенциала реакции, протекающей на данном индикаторном электроде.
Стандартный водородный электрод можно изобразить в виде схемы:
Pt, H2 | H+ (a=1)
Для практической работы стандартный водородный электрод неудобен из-за необходимости получения очень чистого водорода и ряда других причин. Поэтому в качестве электродов сравнения применяют другие электроды.
Хлоридсеребряный (хлорсеребряный) электрод
Хлоридсеребряный электрод сравнения представляет собой серебряную проволоку или пластинку, покрытую слоем хлорида серебра и помещенную в раствор хлорида калия, насыщенный хлоридом серебра (рис. 3).
В хлоридсеребряном электроде протекает полуреакция:
AgClтв + е- ↔ Ag + Cl-
Активность
ионов серебра в таком растворе равна

Если подставить эту величину в уравнение Нернста для серебряного электрода, то получим:

Первые два слагаемых этого уравнения зависят только от температуры:

При сочетании этого уравнения с предыдущим получаем:

Как видно, потенциал хлоридсеребряного электрода определяется активностью хлорид-ионов в растворе. Обычно используется насыщенный раствор хлорида калия. Потенциал электрода второго рода, вообще говоря, зависит от активности аниона малорастворимого соединения, входящего в состав электрода.
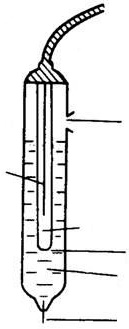

Рис. 3. Хлоридсеребряный электрод сравнения:
1 – серебряная проволока, покрытая слоем AgCl, 2 – асбестовое волокно, обеспечивающее контакт с анализируемым раствором, 3 – внешний насыщенный раствор KCl, 4 – отверстие для контакта,
5 – внутренний насыщенный раствор KCl, 6 – отверстие для ввода раствора KCl
Хотя известны несколько типов хлоридсеребряных электродов, чаще других используют насыщенный хлоридсеребряный электрод. При 250С его потенциал равен (0,222±0,002) В (относительно СВЭ).
Потенциал хлоридсеребряного электрода сравнения изучен при различных концентрационных и температурных условиях и его величины по отношению к СВЭ хорошо известны. Стандартный потенциал хлоридсеребряного электрода при различных температурах может быть рассчитан по уравнению:

