
- •Семинар № 4 «Потенциометрические методы анализа. Метод прямой потенциометрии»
- •Потенциометрические методы анализа: сущность и классификация
- •Электродный потенциал. Уравнение Нернста
- •Установка для потенциометрических измерений – электрохимическая ячейка
- •Индикаторные электроды
- •Редокс-электроды;
- •Металлические электроды I рода
- •Металлические электроды II рода
- •Редокс-электроды
- •Пленочные электроды
- •Электроды сравнения
- •Стандартный водородный электрод
- •Хлоридсеребряный (хлорсеребряный) электрод
- •Каломельный электрод
- •Метод прямой потенциометрии. Основные приемы ионометрического анализа
- •Метод градуировки электрода (метод стандартов);
- •Метод градуировочного (калибровочного) графика;
- •Метод добавок.
- •Метод градуировки электрода (метод стандартов)
- •Метод градуировочного (калибровочного) графика
- •Метод добавок
Семинар № 4 «Потенциометрические методы анализа. Метод прямой потенциометрии»
ПЛАН
1. Потенциометрические методы анализа: сущность и классификация 1
2. Электродный потенциал. Уравнение Нернста 2
3. Установка для потенциометрических измерений – электрохимическая ячейка 5
4. Индикаторные электроды 6
4.1. Металлические электроды I рода 8
4.2. Металлические электроды II рода 8
4.3. Редокс-электроды 8
4.4. Пленочные электроды 9
5. Электроды сравнения 9
5.1. Стандартный водородный электрод 10
5.2. Хлоридсеребряный (хлорсеребряный) электрод 11
5.3. Каломельный электрод 13
6. Метод прямой потенциометрии. Основные приемы ионометрического анализа 14
6.1. Метод градуировки электрода (метод стандартов) 15
6.2. Метод градуировочного (калибровочного) графика 16
6.3. Метод добавок 18
Потенциометрические методы анализа: сущность и классификация
Потенциометрические методы анализа известны еще с конца прошлого века, когда Нернст вывел (1889 г.) известное уравнение, а Беренд (1883 г.) сообщил о первом потенциометрическом титровании. Интенсивное развитие потенциометрии в последние годы связано, главным образом, с появлением разнообразных типов ионселективных электродов, позволяющих проводить прямые определения концентрации многих ионов в растворе, и успехами в конструировании и массовом выпуске приборов для потенциометрических измерений.
В основе потенциометрических методов анализа лежит зависимость равновесного потенциала электрода от активности (концентрации) определяемого иона. Для измерений необходимо составить гальванический элемент из подходящего индикаторного электрода и электрода сравнения, а также иметь прибор для измерения потенциала индикаторного электрода в условиях, близких к термодинамическим, то есть без отвода заметного тока от гальванического элемента при замыкании цепи.
Потенциометрические методы анализа подразделяют на прямую потенциометрию (ионометрию) и косвенную потенциометрию (потенциометрическое титрование). Методы прямой потенциометрии основаны на прямом применении уравнения Нернста для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода. При потенциометрическом титровании точку эквивалентности определяют по резкому изменению (скачку) потенциала вблизи ТЭ.
Электродный потенциал. Уравнение Нернста
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС):
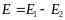 ,
,
где Е – ЭДС, Е1 и Е2 – потенциалы электродов исследуемой цепи.
Потенциал электрода Е связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
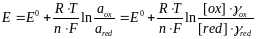 ,
,
где Е0 – стандартный потенциал редокс-системы, В; R – универсальная газовая постоянная, равная 8,312 кДж/(моль·К), Т – абсолютная температура, К; F – постоянная Фарадея, равная 96485 Кл/моль; n – число электронов, принимающих участие в электродной реакции; aox и ared – активности соответственно окисленной и восстановленной форм редокс-системы; [ox] и [red] – равновесные концентрации окисленной и восстановленной форм соответственно; γox и γred – коэффициенты активности.
Е=Е0 при aox=ared=1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного соединения равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении.
Подставляя Т=298,15 К и числовые значения констант в уравнение Нернста, получаем при 250С:
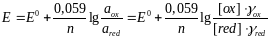
Однако потенциал отдельного электрода определить экспериментально невозможно. Относительные значения электродного потенциала находят, комбинируя данный электрод со стандартным водородным электродом, который является общепринятым международным стандартом. Потенциал стандартного водородного электрода принят равным нулю при всех температурах, поэтому потенциал данного электрода – это, в сущности, ЭДС элемента, состоящего из данного и стандартного водородного электродов.
Данное уравнение можно переписать следующим образом:
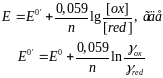
Величину Е0´ называют формальным потенциалом. Как видно, формальный потенциал характеризует систему, в которой концентрации (активности) всех участников равны 1,0 М. Формальный потенциал включает в себя коэффициенты активности, то есть зависит от ионной силы раствора. Если γ=1, то Е0´=Е0, то есть формальный потенциал равен стандартному потенциалу. Точность такого приближения для многих расчетов оказывается достаточной.
Природа возникновения потенциала различна. Можно выделить следующие три основные класса потенциалов, которые не исчерпывают, конечно, всего многообразия. Это:
электродные потенциалы;
редокс-потенциалы;
мембранные потенциалы.
Хотя под термином «электродный потенциал» нередко имеют в виду любой другой потенциал, независимо от механизма его возникновения, в более узком понимании – это потенциал непосредственно связанный с материалом электрода. Например, цинковый электрод:
Zn2+ + 2e- = Zn
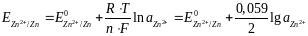
Активность свободного металла принимается равной единице. Электродные потенциалы отличаются от редокс-потенциалов, для которых материал электрода не имеет значения, так как они химически инертны по отношению ко всем веществам в растворе, и от мембранных, для которых разность потенциалов на мембране измеряется с помощью пары других (в принципе, возможно, одинаковых) электродов.
