
- •Семинар № 3 «Ионселективные электроды»
- •Практическое значение измерения активности ионов. Достоинства и недостатки метода ионометрии
- •Классификация ионселективных электродов
- •Сенсибилизированные (активированные) электроды:
- •Основные характеристики ионселективных электродов
- •Диффузионный потенциал
- •Конструкции ионселективных электродов
- •Электроды с кристаллическими мембранами
- •Электроды с жесткой матрицей (стеклянные электроды)
- •Механизм возникновения потенциала на стеклянной мембране
- •Электроды на основе мембран с подвижными носителями (жидкостные ионселективные электроды)
- •Сенсибилизированные (активированные) электроды
- •Газочувствительные электроды
- •Ферментные электроды
- •Определяемое вещество (субстрат) Ион (молекула)
Конструкции ионселективных электродов
Электроды с кристаллическими мембранами
Кристаллические гомогенные мембраны изготавливают из индивидуального кристаллического соединения (LaF3, Ag2S) или гомогенной смеси кристаллических веществ (Ag2S+AgCl, Ag2S+CuS). Если мембрана состоит только из одного кристаллического вещества, то она может быть либо монокристаллом либо изготовлена прессованием или спеканием многих мелких кристаллов в виде поликристаллического диска. Так мембрану хлорид- и бромид-селективных электродов изготавливают из монокристаллов (хлорида или бромида серебра) или поликристаллических смешанных таблеток. Такие мембранные электроды называются гомогенными. При изготовлении гетерогенных кристаллических мембран электродно-активное вещество смешивают с инертной матрицей (силиконовая смола, эпоксидные смолы, поливинилхлорид) или наносят гидрофобизованный графит. В качестве ионочувствительного активного вещества используются различные малорастворимые соединения, такие, как, сульфат бария, оксалат кальция и др. Электрическая проводимость этих мембран обусловлена способностью иона решетки с наименьшим радиусом и зарядом перемещаться по вакансиям решетки.
Для кристаллических мембран характерна высокая специфичность, обусловленная тем, что размер, форма и распределение заряда вакансии решетки позволяют занять это место только определенному подвижному иону. Низкая растворимость материала мембраны позволяет достигать очень низких пределов обнаружения. Состав наиболее распространенных кристаллических мембран приведен в таблице 1.
Таблица 1
Состав наиболее распространенных кристаллических мембран
Определяемый ион |
Состав мембраны |
F- |
LaF3 |
Cl- |
AgCl или AgCl+Ag2S |
Br- |
AgBr или AgBr+Ag2S |
I- |
AgI или AgI+Ag2S |
SCN- |
AgSCN+Ag2S |
S2- |
Ag2S |
Ag+ |
Ag2S |
Cu2+ |
Cu1,8Se или CuS+Ag2S |
Pb2+ |
PbS+Ag2S |
Cd2+ |
CdS+Ag2S |
Практическое значение имеет ионселективный электрод с мембраной из сульфида серебра, пригодный для измерения концентрации (активности) и Ag+- и S2--ионов. Сульфид серебра является превосходным электродно-активным веществом и обладает малой растворимостью (Ks~10-51), высокой устойчивостью к окислителям и восстановителям, низким электрическим сопротивлением. Мембрану можно изготовить из прессованного кристаллического сульфида серебра или из пластинки монокристалла. Подвижными в мембране из сульфида серебра являются ионы серебра. Серебро этим электродом может быть определено в интервале от 1 до 10-7 М, а в некоторых условиях и до 10-12 М и ниже. В столь же низких концентрациях могут быть определены и сульфид-ионы.
На основе мембраны их сульфида серебра конструируются также различные галогенидные и металлочувствительные электроды. Для этого в сульфид серебра вводят галогениды серебра или сульфиды меди, свинца, кадмия и некоторых других металлов.
Электроды на основе сульфида серебра с добавкой соответствующего галогенида серебра чувствительны к ионам Cl-, Br-, I-, CN- и др. Введение в сульфид серебра сульфидов других металлов позволяет получить электрод, чувствительный к ионам металла, внесенного со вторым сульфидом (Cd2+, Pb2+, Cu2+ и др.).
Используются также электроды на основе сульфида или селенида меди, чувствительные к ионам меди.
Электроды, выпускаемые промышленностью на основе кристаллических мембран, состоят из пластмассового корпуса (поливинилхлорид, тефлон и др.), в конец которого вклеен или плотно вставлен в оправу монокристалл или прессованная мембрана. Пластмассовый корпус заполняется раствором, содержащим ион, на который данный электрод реагирует. И наконец, в эту трубку погружают электрод сравнения; раствор, заполняющий трубку, следовательно, должен содержать также ион, на который реагирует электрод сравнения.
Характерная особенность всех кристаллических мембран заключается в том, что электрический ток переносится через них только ионами. Ионами-переносчиками заряда могут служить ионы только определенного размера, такого, на который реагирует сам электрод, например, ионы серебра, меди и т.д. такой реакцией обладают все ионселективные электроды. Ее называют первичной реакцией. Электроды могут обладать также и вторичной реакцией, когда они реагируют на противоион труднорастворимого соединения кристалла мембраны. Например, электрод с электродно-активной фазой из сульфида серебра можно использовать для определения концентрации (активности) ионов серебра в растворах солей серебра и сульфид-ионов в сульфидных растворах. Подобными свойствами обладают хлорид-, бромид-, иодид-, тиоцианат-селективные электроды, имеющие первичную реакцию на ионы серебра.
Нижний предел чувствительности электрода определяется произведениями растворимости входящих в состав мембраны соединений.
На работу электродов с гомогенными кристаллическими мембранами оказывают влияние ионы и рН раствора. Хотя ионы водорода непосредственно не участвуют в электродной реакции, они могут с некоторыми определяемыми ионами образовывать слабо диссоциирующие соединения, такие как HF, H2S, HCN, HSCN. Так как образующиеся водородосодержащие соединения представляют собой газы, то они легко улетучиваются из раствора и поэтому первоначальное содержание анионов в пробе может не соответствовать определяемому. При слишком высоком значении рН раствора могу выпадать в осадок соответствующие гидроксиды металлов, главным образом, при определении меди, кадмия, свинца, и показания, таким образом, уменьшаются. Необходимое значение рН раствора связано, прежде всего, с химической природой соответствующего измеряемого иона.
В таблице 2 приведены значения оптимального интервала рН раствора и области концентрации ионов, определяемых при помощи ионселективных электродов с кристаллическими мембранами.
Таблица 2
Характеристики ионселективных электродов с гомогенными
кристаллическими мембранами
Определяемый ион |
Интервал измерения, pC |
Оптимальный интервал рН раствора |
Мешающие ионы |
Применение |
Cl- |
0-4,3 |
2-11 |
S2-, I-, Br-, CN- |
Анализ пищевых продуктов, фарм. препаратов, мыл, пластиков, стекла, вод |
Br- |
0-5,3 |
2-12 |
S2-, I-, CN- |
Титрование эпоксигрупп HBr |
I- |
0-7,3 |
3-12 |
S2-, CN- |
- |
F- |
0-6 |
5-8 |
OH- |
Анализ вод, электролитических ванн, зубных паст, тканей, зубов и костей |
SCN- |
0-5 |
2-12 |
I-, Cl-, сильные восстановители |
- |
CN- |
0-6 |
11-13 |
S2-, I- |
Анализ промышленных стоков, электролитических ванн, определение амигдалина |
Cu2+ |
0-8 |
3-7 |
S2-, Ag+, Hg2+, Cl-, Br-, Fe3+ |
Анализ электролитических ванн, вод, пищевых продуктов, сточных вод, рудных концентратов, фунгицидов |
Cd2+ |
1-7 |
3-7 |
Fe3+, Pb2+, Ag+, Hg2+, Cu2+ |
Анализ вод, промышленных отходов, электролитических ванн, бумаги и пигментов |
Pb2+ |
1-7 |
4-7 |
Cd2+, Ag+, Hg2+, Cu2+, Fe3+ |
Анализ нефтяных продуктов, пищевых продуктов, загрязнений, воздуха, определение Pb с ЭДТА и SO42- раствором Pb2+ |
S2- |
0-17 |
13-14 |
нет |
Анализ промышленных отходов, продуктов бумажной и целлюлозной промышленности |
Ag+ |
0-17 |
2-9 |
Hg2+ |
Титрование смеси галогенидов или цианидов раствором Ag+ |
F--селективный электрод
Наиболее совершенным ионселективным электродом с кристаллической мембраной является фторид-селективный (фторидный) электрод, изображенный на рисунке 4.
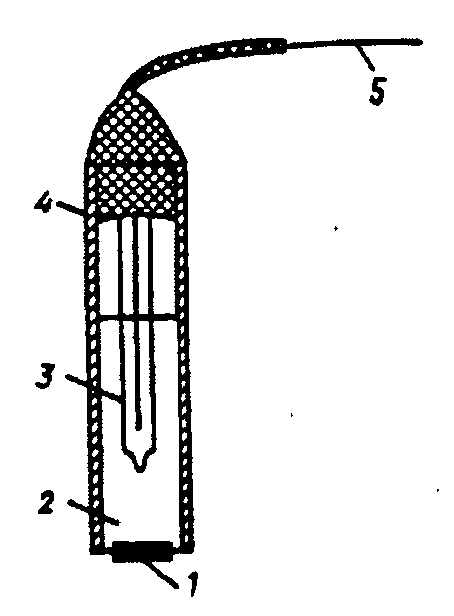
Рис. 4. Фторид-селективный электрод:
1 – пластинка из LaF3, 2 – утренний стандартный раствор NaF+NaCl, 3 – внутренний электрод сравнения, 4 – изоляция, 5 – токоотвод
Мембрана его изготовлена из пластинки монокристалла фторида лантана, имеющего чисто фторидную проводимость и активированного для увеличения дефектов решетки (понижения электрического сопротивления) фторидом двухзарядного катиона (бария, европия). Монокристалл имеет гексагональную решетку, состоящую из слоев фторида лантана, окруженных фторид-ионами, пять из которых находятся в непосредственной близости. В такого рода решетке фторид-ионы отличаются высокой подвижностью.
Перенос заряда в таком монокристалле происходит за счет дефектов кристаллической решетки:
LaF3 + Вакансия (дырка) → LaF2+ + F-
Чувствительность фторид-селективного электрода позволяет проводить измерения равновесной концентрации фторид-ионов в широкой области концентраций – от 10-6 до 1 М. В этой области отклонений от уравнения Нернста не наблюдается. Селективность электрода очень высока – даже тысячекратный избыток посторонних ионов (галогенид-, нитрат-, сульфат-ионов и др.) по сравнению с фторид-ионами не мешает определению последних и только в присутствии гирокисид-ионов селективность падает (ОН--ион является мешающим). Работа фторид-селективного электрода ухудшается также в присутствии лигандов, образующих с ионами La3+ прочные координационные соединения в растворе (цитрат-, оксалат-ионы и др.). Существенно мешают определению активности фторид-ионов только катионы, образующие комплексные соединения с фторид-ионами – Al3+, Fe3+, Ce4+, Li+, Th4+. При определении концентрации (активности) фторид-ионов в присутствии таких ионов, как Al3+ и Fe3+ необходимо в раствор добавлять комплексообразующий реагент R, который в свою очередь образует еще более устойчивые комплексы с данными катионами металлов по реакции вытеснения, при этом выделяются фторид-ионы, которые можно измерить при помощи электрода, например:
AlF63- + R3- ↔ AlR + 6F-
Подходящими комплексообразующими реагентами являются цитраты, ЭДТА, ЦГДА и др.
Вполне понятно также, что с увеличением кислотности среды равновесная концентрация фторид-ионов в растворе уменьшается за счет образования молекул HF, на которые электрод не дает отклика (электродный потенциал при этом возрастает и становится более положительным):
H+ + 3F- ↔ HF + 2F- ↔ HF2- + F- ↔ HF32-
Таким образом, показания фторидного электрода в кислой области будут существенно зависеть от рН. В щелочной области на поверхности электрода может образоваться осадок La(OH)3, что также вызовет искажение показаний электрода (потенциал электрода при этом уменьшается и становится более отрицательным):
LaF3 + 3OH- ↔ La(OH)3 + 3F-
Точные границы рН, в которых показания фторидного электрода от рН зависят несущественно, привести трудно, так как с уменьшением концентрации фторид-ионов эта область также уменьшается. Для растворов с концентрацией фторид-ионов n·10-4 М и более этот интервал охватывает область значений рН примерно от 4-5 до 8-9, чего можно добиться при помощи ацетатного буферного раствора.
Зависимость потенциала фторид-селективного электрода от рН раствора иллюстрирует рисунок 5.


Рис. 5. Зависимость потенциала фторид-селективного электрода от рН раствора
Фторидный электрод используется для определения фторид-ионов в питьевой и морских водах, различных биологических пробах, витаминах, молоке, при контроле за загрязнением окружающей среды, в пищевых продуктах и т.д. Он широко применяется также для исследования процессов образования фторидных комплексов в растворе и других реакций с участием фторид-ионов.
