
- •II вопросы для самоконтроля
- •III литература:
- •Занятие №2 электропроводность растворов электролитов
- •II вопросы для самоконтроля
- •III литература:
- •Занятие №3 кондуктометрия. Кондуктометрическое титрование
- •I. План изучения темы
- •II. Вопросы для самоконтроля:
- •Лабораторная работа:
- •Занятие №4 электродные процессы. Классификация электродов.
- •II. Вопросы для самоконтроля:
- •Занятие № 5 термодинамика гальванического элемента потенциометрия
- •Лабораторная работа:
- •1. Евстратова к. И. , Купина н. А. , Малахова е. Е. "Физическая и коллоидная химия". М. 1990 - стр.160-200.
- •3. 3. Голиков г.А. «Руководство по физической химии». М. 1988. Стр. 245-248
- •3. Лекционный материал. Занятие №6 потенциометрическое титрование
- •Лабораторная работа:
- •3. Лекционный материал. Занятие №7 полярографический метод анализа
- •Занятие №9 свойства буферных растворов
- •IV. Вопросы для самоконтроля:
- •V Лабораторная работа
- •I. Рассчитать объемы растворов кислоты и соли, которые надо взять для смешивания.
- •III. Методом потенциометрии измерить значение рН полученного раствора.
- •IV. Сравнить экспериментальное значение рН с заданным. Определить погрешность приготовления раствора. Задание №2
- •VI. Литература:
- •6. Лекционный материал.
- •Рефрактометрия
- •2. Лекционный материал. Занятие №11 формальная химическая кинетика
- •3. Голиков г.А. «Руководство по физической химии». М. 1988. Стр.253-258, 265-274.
- •4. Лекционный материал. Лабораторная работа
- •Занятие №12 кинетика химических реакций различных порядков
- •3. Голиков г.А. «Руководство по физической химии». М. 1988. Стр.258-265.
- •4. Лекционный материал. Лабораторная работа
- •Занятие №13 влияние температуры на скорость химической
- •3. Голиков г.А. «Руководство по физической химии». М. 1988. Стр.276-296.
- •4. Лекционный материал. Лабораторная работа
- •Занятие №14 каталические реакции. Ферментативный катализ.
- •3. Голиков г.А. «Руководство по физической химии». М. 1988. Стр. 338-363.
- •4. Лекционный материал. Лабораторная работа
- •Занятие №15 основы фармакокинетики
- •I. План
- •II. Цель самоподготовки
- •VI. Литература.
- •2. Лекционный материал. Занятие №16
- •(Коллоквиум)
V Лабораторная работа
ПРИГОТОВЛЕНИЕ АЦЕТАТНОГО БУФЕРНОГО РАСТВОРА С ЗАДАННЫМ ЗНАЧЕНИЕМ рН И ИЗМЕРЕНИЕ ЕГО БУФЕРНОЙ ЕМКОСТИ
Буферными называют растворы, способные поддерживать постоянство рН среды при добавлении небольших количеств кислоты, щелочи или при разведении.
Буферные растворы используются для поддержания необходимой кислотности среды при проведении ряда химических реакций в лаборатории и в различных технологических процессах; как стандартные растворы при определении рН; при определении ИЭТ белков и др.
Если необходимо приготовить буферный раствор, состоящий из слабой кислоты и соли, образованной этой кислотой и сильным основанием, то для расчета следует использовать уравнение в виде:
![]()
При равенстве концентраций растворов кислоты и соли, взятых для приготовления буферного раствора, уравнение будет иметь вид:
![]()
Задание №1: Приготовить 20 мл ацетатного буферного раствора с заданным преподавателем значением рН, используя растворы СН3СООН и СН3СООNa c концентрациями 0,1 моль/л.
значение константы диссоциации СН3СООН принять равным 1,75 10–5.
I. Рассчитать объемы растворов кислоты и соли, которые надо взять для смешивания.
II. Приготовить буферный раствор.
В сухую колбу или стакан внести, отмерив пипеткой рассчитанные объемы (мл) растворов СН3СООН и СН3СООNa с концентрациями 0,1 моль/л. Содержимое колбы перемешать.
III. Методом потенциометрии измерить значение рН полученного раствора.
IV. Сравнить экспериментальное значение рН с заданным. Определить погрешность приготовления раствора. Задание №2
Определить буферную емкость полученного буферного раствора методом потенциометрии.
VI. Литература:
1. К.И.Евстратова, Н.А.Купина, Е.Е.Малахова. Физическая и коллоидная химия. М., 1990, с.114-116, 123-131.
2. Методические рекомендации к формированию практических навыков по физической и коллоидной химии. Курск,1999.
3. М.И.Равич-Щербо, В.В.Новиков. Физическая и коллоидная химия. М., 1975, с.90-100.
4. Ленский А. С. Введение в бионеорганическую и биофизическую химию. М., Высшая школа, 1989г.
5. Зеленин Химия: Учебник для медицинских вузов.- Сп-Б.: Спецлитература, 1997, 163-178с.
6. Лекционный материал.
Список дополнительной литературы:
1. Ганг Р. Физическая химия с приложением к биологическим системам. М., Мир,1980.
2. Уильямc В., Уильямc Х. Физическая химия для биологов. М., Мир, 1980.
3. Бладугрен В. Физическая химия в медицине и биологии М., Иностр.лит-ра,
З А Н Я Т И Е №10
Рефрактометрия
ПЛАН
1. Показатель преломления.
2. Факторы, влияющие на показатель преломления.
3. Связь показателя преломления с диэлектрической проницаемостью.
4. Зависимость показателя преломления от состава.
5. Рефрактометрия. Аппаратура, область применения.
При подготовке к занятию использовать методические рекомендации предыдущего занятия.
Литература.
1. Евстратова К.И. , Купина Н.А. , Малахова Е.Е. "Физическая и коллоидная химия". М. 1990 - стр. 251-256.
2. Лекционный материал. Занятие №11 формальная химическая кинетика
Знание закономерностей, которым подчиняется скорость химических реакций, позволяет контролировать и направлять течение химических процессов.
ПЛАН
Предмет химической кинетики и ее задачи.
Основные принципы химической кинетики.
Кинетические кривые различных химических реакций.
Скорость химической реакции и ее определение. По изменению концентрации какого из веществ обычно определяют скорость реакции?
Средняя, истинная (мгновенная), удельная скорости реакции. Какой физический смысл имеет константа скорости химической реакции? От чего зависит и от чего не зависит константа скорости химической реакции?
Молекулярность реакции. Порядок химической реакции. Всегда ли молекулярность и порядок реакции имеют одинаковые значения? Привести примеры. Какие реакции называют псевдомолекулярными?
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Приведите определение понятия “скорость химической реакции”.
2. Запишите аналитическое выражение для расчета:
а) средней скорости химической реакции,
б) мгновенной скорости химической реакции.
3. Приведите графическую зависимость:
а) изменения концентрации исходных веществ во времени;
б) изменения концентрации конечных продуктов во времени.
Используя графическую зависимость изменения концентрации исходных веществ во времени, проиллюстрируйте:нахождение средней и мгновенной скорости реакции.
На графике С = f(t) представлены две кривые, описывающие изменение концентрации реагирующих веществ во времени. Скорость какой реакции (I ил II) больше?
С

1
2

t
Разложение закиси азота при высоких температурах протекает по уравнению:
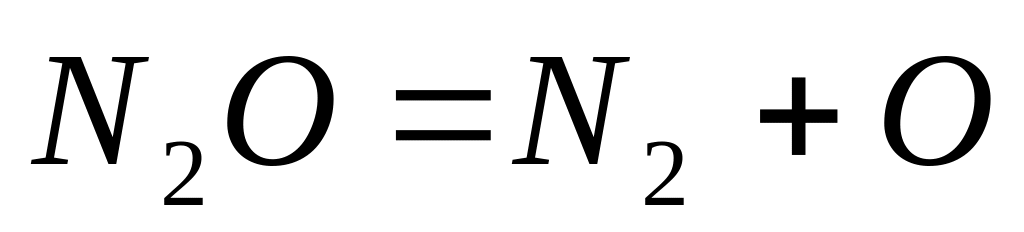
а) в каком случае начальная скорость разложения закиси азота будет выше: при
С0 = 1,5 моль/дм3 или С0 = 3,2 моль/дм3? Почему?
б) при одной и той же начальной концентрации при t1 = 9000С или при t2 = 12000С. Почему?
Разложение закиси азота протекает по уравнению . Константа скорости данной реакции равна 0,0005 при температуре 9000С. Начальная концентрация закиси азота равна 3,2 моль/дм3. Определите скорость реакции при указанной температуре в начальный момент времени.
Реакция между веществами А и В протекает по уравнению: А + 2В →С. Концентрация вещества А = 1,5 моль/ моль/дм3, а вещества В = 3 моль/дм3. Константа скорости реакции = 0,4. Вычислите скорость химической реакции при указанной температуре в начальный момент времени.
Дайте определение понятия «константа скорости химической реакции».
Назовите два фактора, влияющие на величину константы скорости химической реакции.
Дайте определение понятий «молекулярность», «порядок» реакции.
Приведите классификацию химических реакций по молекулярности.
Приведите классификацию химических реакций по порядку.
Какими свойствами обладают реакции:
а) I-го порядка,
б) II-го порядка,
в) III-го порядка,
г) дробного порядка,
д) нулевого порядка.
15.По какому признаку выделяют реакции:
а) одномолекулярные,
двумолекулярные,
тримолекулярные.
16.Почему молекулярность реакции обычно не бывает больше трех.
17.назовите три основные условия, выполнение которых необходимо для осуществления акта химического взаимодействия.
18.По какому признаку выделяют псевдомолекулярные реакции?
19.Приведите пример реакций I и II порядков.
20.Приведите пример реакций:
а) одномолекулярной,
б) двумолекуляной,
в) тримолекулярной,
г) псевдомолекулярной.
ЛИТЕРАТУРА:
1. Евстратова К. И. , Купина Н. А. , Малахова Е. Е. "Физическая и коллоидная химия" - стр.260-266.
2. Стромберг А. Г. , Семченко Д. П. "Физическая химия" - стр. 284-300.
